Слайд 1Марганец
Автор: Зина Парижева
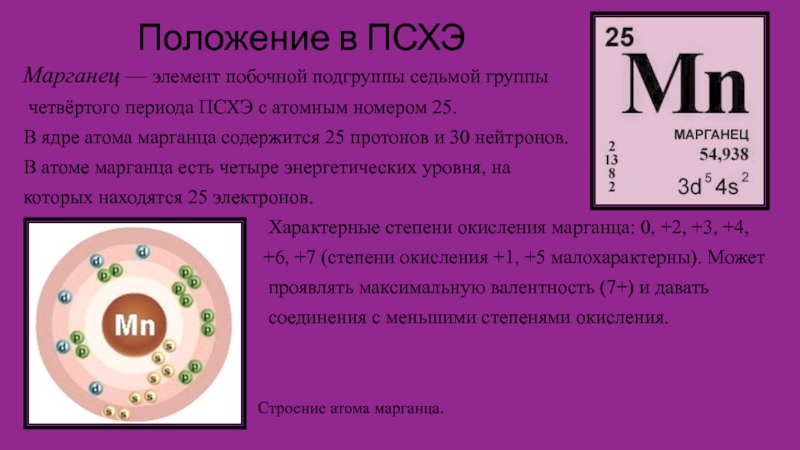
Слайд 2Положение в ПСХЭ
Марганец — элемент побочной подгруппы седьмой группы
четвёртого
периода ПСХЭ с атомным номером 25.
В ядре атома марганца содержится
25 протонов и 30 нейтронов.
В атоме марганца есть четыре энергетических уровня, на
которых находятся 25 электронов.
Характерные степени окисления марганца: 0, +2, +3, +4,
+6, +7 (степени окисления +1, +5 малохарактерны). Может
проявлять максимальную валентность (7+) и давать
соединения с меньшими степенями окисления.
Строение атома марганца.
Слайд 3Нахождение в природе
14-й элемент по распространённости на Земле, а после
железа — второй тяжёлый металл, содержащийся в земной коре (0,03
% от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г/т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. Марганец, рассеянный в горных породах, вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7—10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 %.
В России является остродефицитным сырьём, известны месторождения: «Усинское, «Полуночное», «Порожинское», «Южно-Хинганское», «Рогачёво-Тайнинская» площадь и «Северо-Тайнинское» поле.
Слайд 4Получение
Один из основных минералов марганца - пиролюзит - был известен
в древности как чёрная магнезия и использовался при варке стекла
для его осветления. Его считали разновидностью магнитного железняка, а тот факт, что он не притягивается магнитом, Плиний Старший объяснил женским полом чёрной магнезии, к которому магнит «равнодушен». Карл Шееле в 1774 году показал, что пиролюзит — соединение неизвестного металла. В том же году Юхан Готлиб Ган, стал первым человеком, который получил чистый марганец и доказал, что это отдельный элемент.
Марганец получают следующими способами:
Восстановлением железосодержащих оксидных
руд марганца коксом. (карботермическое восстано-
вление).
2. Восстановлением Mn2O3, образующийся при про-
каливании пиролюзита металлическим алюминием.
MnO2 = 2Mn2O3+O2, Mn2O3+2Al = 2Mn+Al2O3
3.Чистый марганец получают электролизом водных
растворов сульфата марганца MnSO4.
Слайд 5Физические свойства
Металл серебристо-белого цвета. Наряду с
железом и его сплавами
относится к чёрным
металлам. Известны пять аллотропных
модификаций марганца -
четыре с кубической
и одна с тетрагональной кристаллической
решёткой.
1.Плотность (н. у.) – 7,21 г/см³
2.Температура плавления – 1517 K
3.Температура кипения – 2235 K
4.Теплопроводность при 300 K – 6,87 Вт/(м·К)
5. Твёрдость по шкале Мооса: 4
6. Марганец парамагнитен.
Слайд 6Химические свойства
I.Взаимодействие с неметаллами.
1.Легко окисляется кислородом воздуха с образованием
оксидов различного состава:
выше 800°С образуется смешанный оксид марганца (II, III):
3Mn + 2O2 = Mn3O4;
при температуре 450 – 800°С получается оксид марганца (III): 4Mn + 3O2 = 2Mn2O3
ниже 450°С образуется оксид марганца (IV): Mn + O2 = MnO2.
2.С галогенами, кроме фтора, дает галогениды марганца (II):
Mn + Cl2 = MnCl2.
3.При нагревании реагирует с серой, азотом, фосфором, углеродом, кремнием:
Mn + S = MnS;
II.Взаимодействие с водой. При комнатной температуре очень медленно взаимодействует с водой, при нагревании с умеренной скоростью:
Mn + 2H2O = MnO2 + 2H2.
В щелочном растворе марганец устойчив.
Слайд 7Химические свойства
III.Взаимодействие с кислотами
1.В электрохимическом ряду напряжений металлов марганец находится
до водорода, он вытесняет водород из растворов неокисляющих кислот, при
этом образуются соли марганца (II):
Mn + 2HCl = MnCl2 + H2;
2.С разбавленной азотной кислотой образует нитрат марганца (II) и оксид азота (II): 3Mn + 8HNO3 = 3Mn(NO3)2 + 2NO + 4H2O.
3.Концентрированная азотная и серная кислоты пассивируют марганец. Марганец растворяется в них лишь при нагревании, образуются соли марганца (II) и продукты восстановления кислоты:
Mn + 2H2SO4 = MnSO4 + SO2 + 2H2O; Mn + 4HNO3 = Mn(NO3)2 + 2NO2 + 2H2O.
IV.Восстановление металлов из оксидов
Марганец – активный металл, способен вытеснять металлы из их оксидов:
5Mn + Nb2O5 = 5MnO + 2Nb.
Слайд 8Соединения
Оксид и гидроксид марганца (II) проявляют только основные свойства. Они
нерастворимы в воде, но легко растворяются в кислотах с образованием
солей двухвалентного марганца. Большинство солей двухвалентного марганца хорошо растворимы в воде и подвергаются гидролизу по катиону. К труднорастворимым солям относятся средние соли – сульфид, фосфат и карбонат. В кристаллическом состоянии соли марганца (II) имеют слабо розовую окраску, в водных растворах – практически бесцветны.
Слайд 9Применение
В промышленности. Соединения марганца применяют и при изготовлении гальванических элементов;
в производстве стекла и в керамической промышленности; в красильной и
полиграфической промышленности, в сельском хозяйстве. Основной потребитель марганца - черная металлургия. Марганец в виде ферромарганца применяется для удаления кислорода из стали при её плавке. Кроме того, он связывает серу, что также улучшает свойства сталей. Такая сталь используется для изготовления шаровых мельниц, землеройных и камнедробильных машин, броневых элементов. Манганин обладает высоким электросопротивлением, мало изменяющимся с изменением температуры, поэтому его применяют для изготовления реостатов и пр. Гальваническое покрытие марганца применяется для защиты металлических изделий от коррозии.
В химии. Значительное количество диоксида марганца потребляется при производстве марганцево-цинковых гальванических элементов, MnO2 используется в таких элементах в качестве окислителя-деполяризатора. Соединения марганца также широко используются как в тонком органическом синтезе (MnO2 и KMnO4 в качестве окислителей), так и промышленном органическом синтезе (например, в производстве терефталевой кислоты окислением p-ксилола, окисление парафинов в высшие жирные кислоты).
В медицине. В медицине некоторые соли Марганца (например, KMnO4) применяют как дезинфицирующие средства.

Слайд 10Биологическое значение
Марганец является элементом, широко распространённым в природе, он присутствует
в большинстве тканей растений и животных. Является микроэлементом. Марганец оказывает
влияние на рост, образование крови и функции половых желёз. Самые высокие концентрации находятся в листьях свёклы, апельсиновой корке, винограде, ягодах, спарже, ракообразных, брюхоногих, двустворчатых. Он является важным элементом во всех известных живых организмах. Например, фермент, ответственный за превращение молекул воды в кислород во время фотосинтеза, содержит четыре атома марганца. Средний человеческий организм содержит около 12 миллиграммов этого металла. Мы получаем около 4 миллиграммов каждый день из
таких продуктов, как орехи, отруби, злаки, чай и петрушка.
Этот элемент делает кости скелета более прочными. Он
также важен для усвоения витамина B1. Токсическая доза
для человека составляет 40 мг марганца в день. Летальная
доза для человека не определена. Марганец относится к
наименее ядовитым микроэлементам. Главными признаками
отравления марганцем у животных являются угнетение
роста, понижение аппетита, нарушение метаболизма железа
и изменение функции мозга.