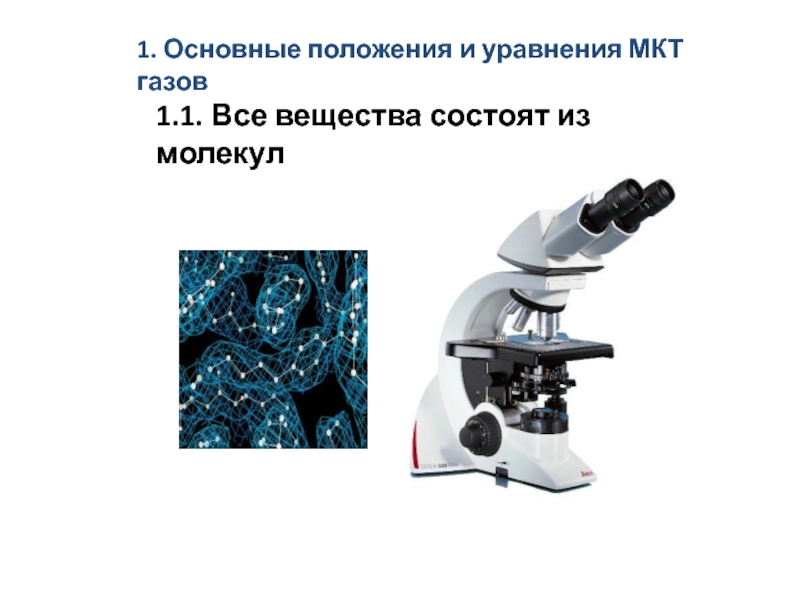
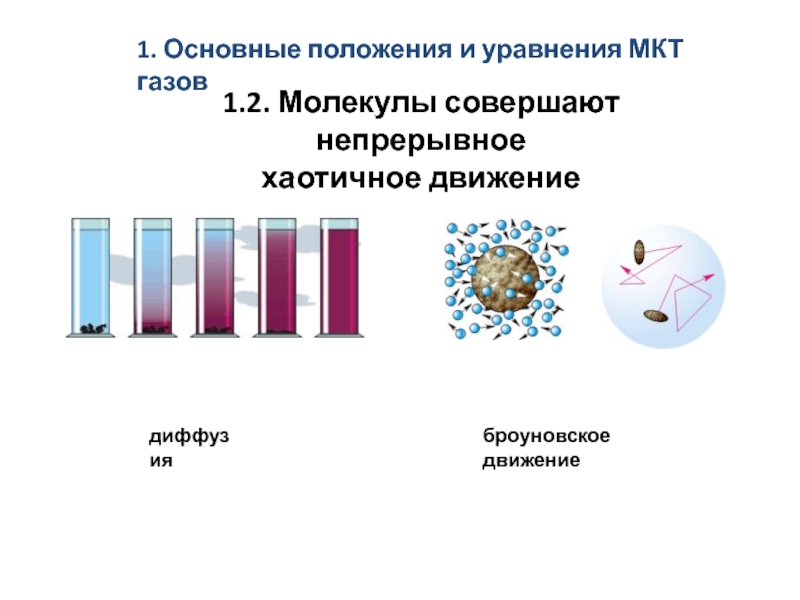
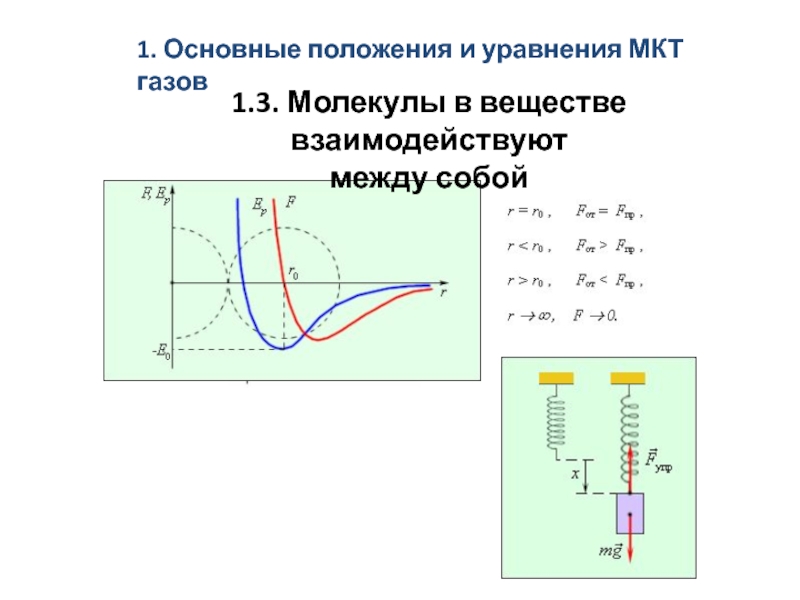
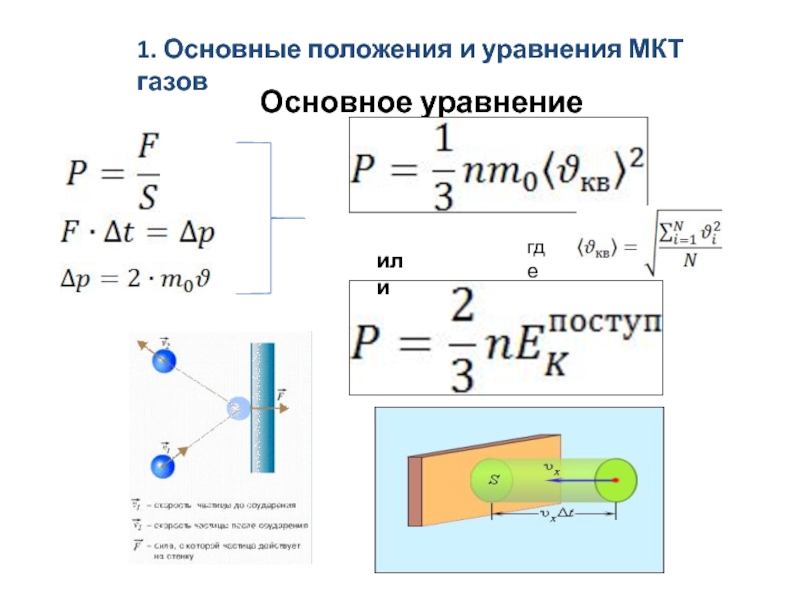
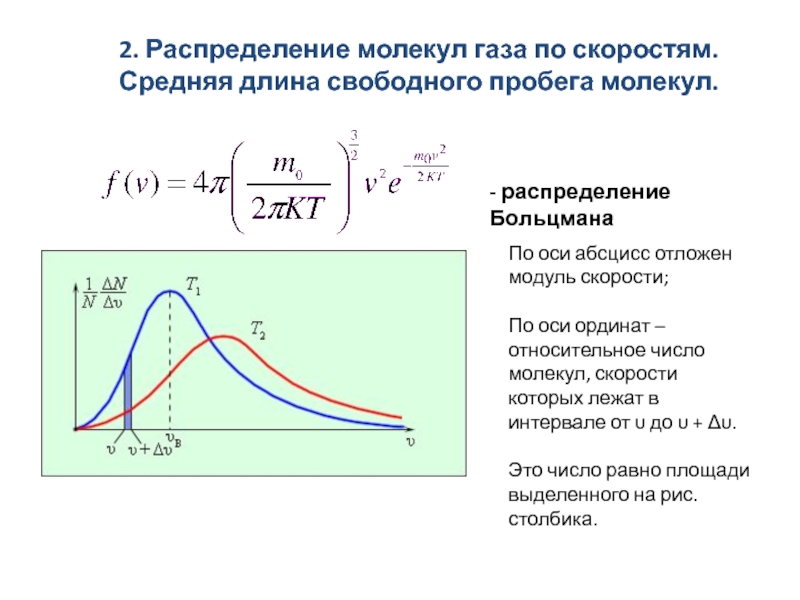
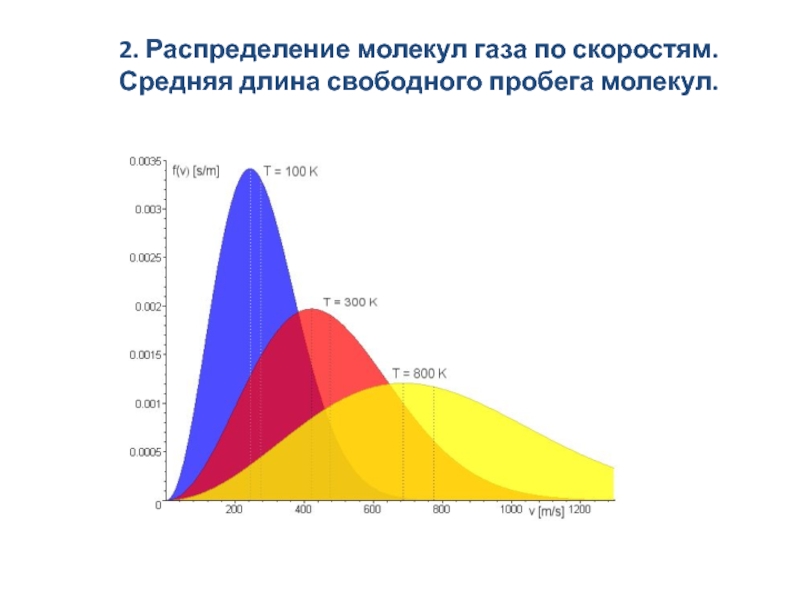
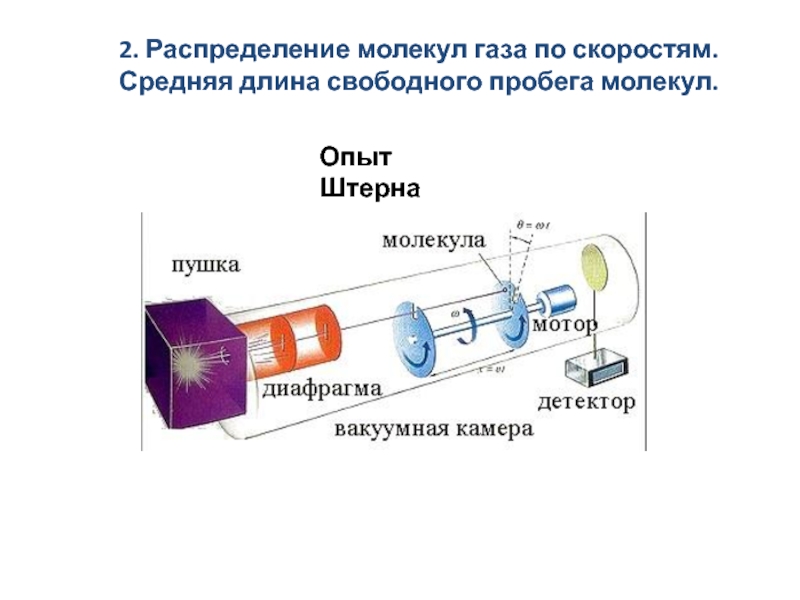
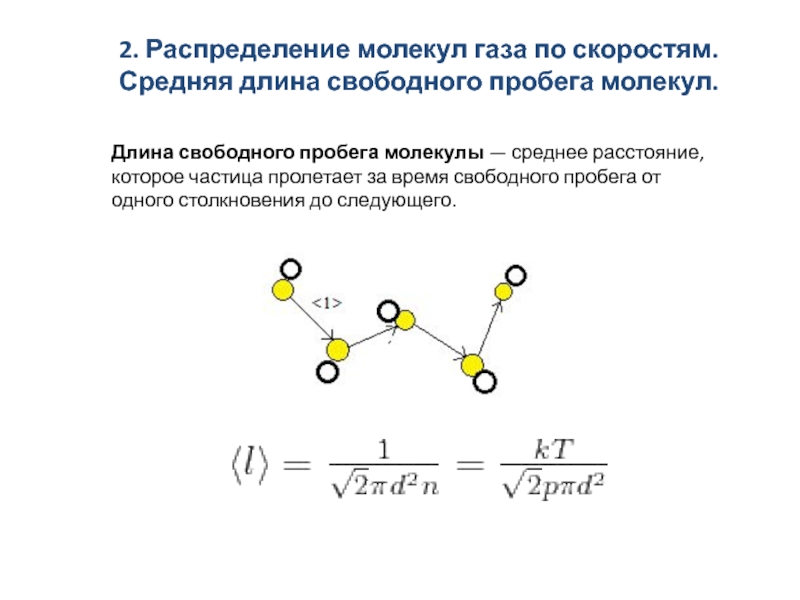
скоростям. Средняя длина свободного пробега молекул.
Явления переноса в термодинамически неравновесных
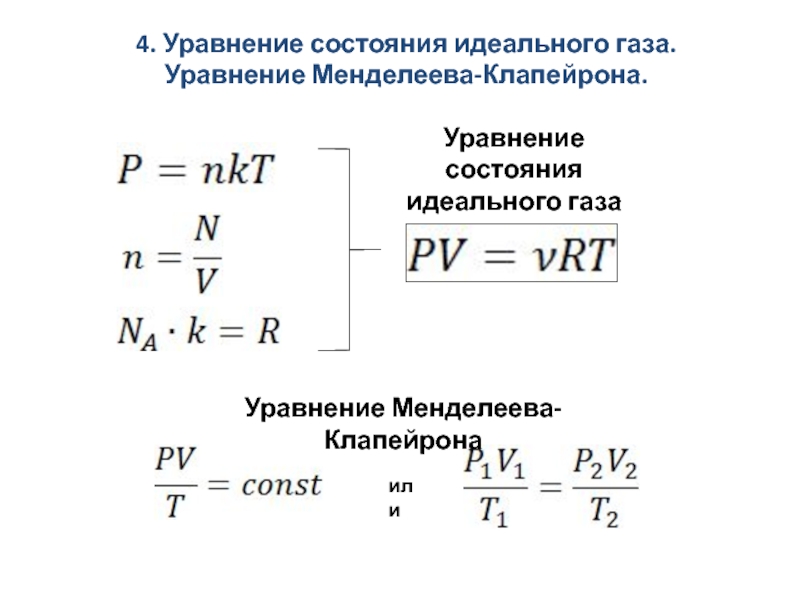
системах (диффузия, вязкость, теплопроводность).Уравнение состояния идеального газа. Уравнение Менделеева-Клапейрона.
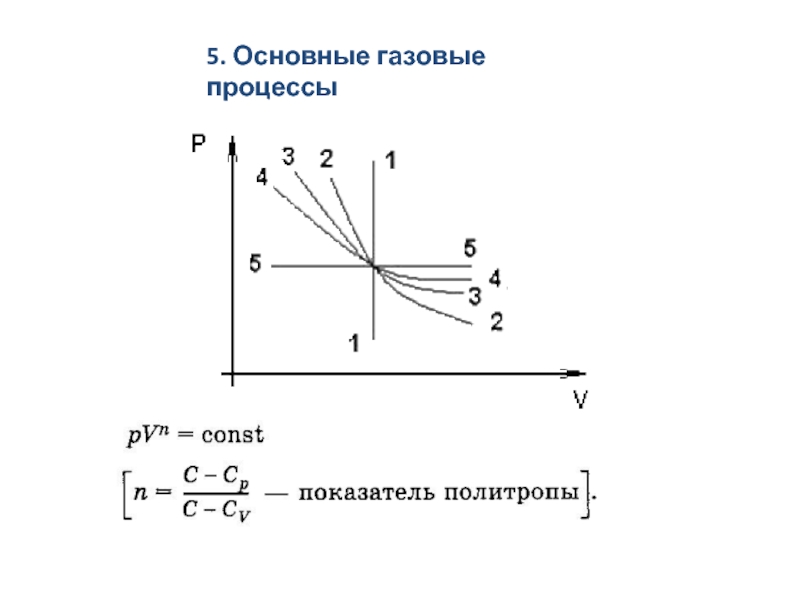
Основные газовые процессы.