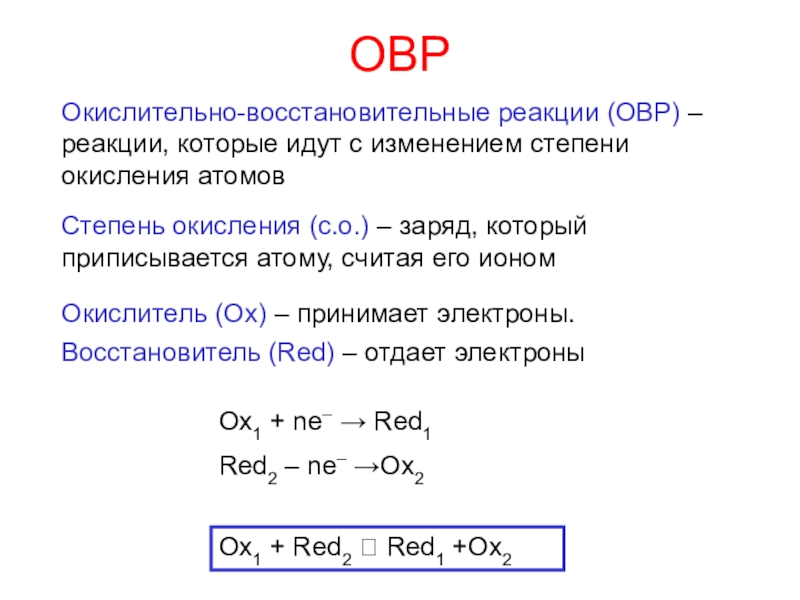
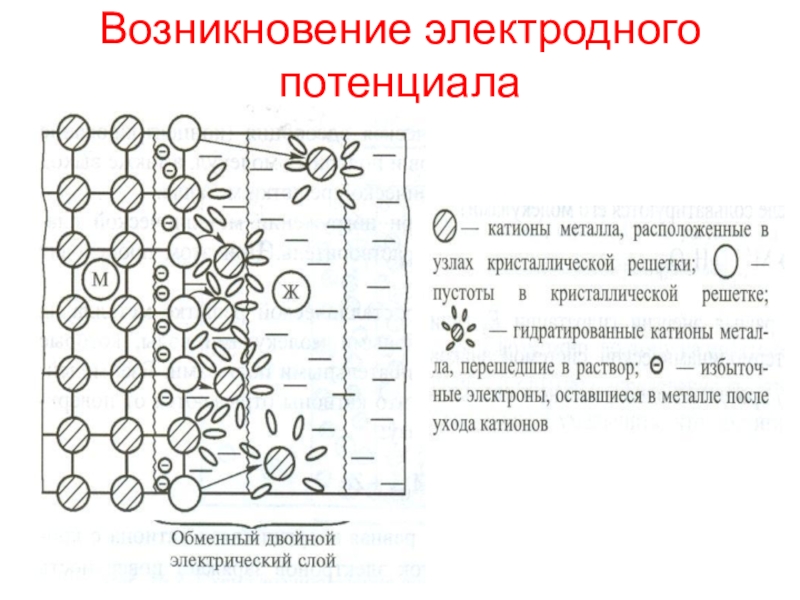
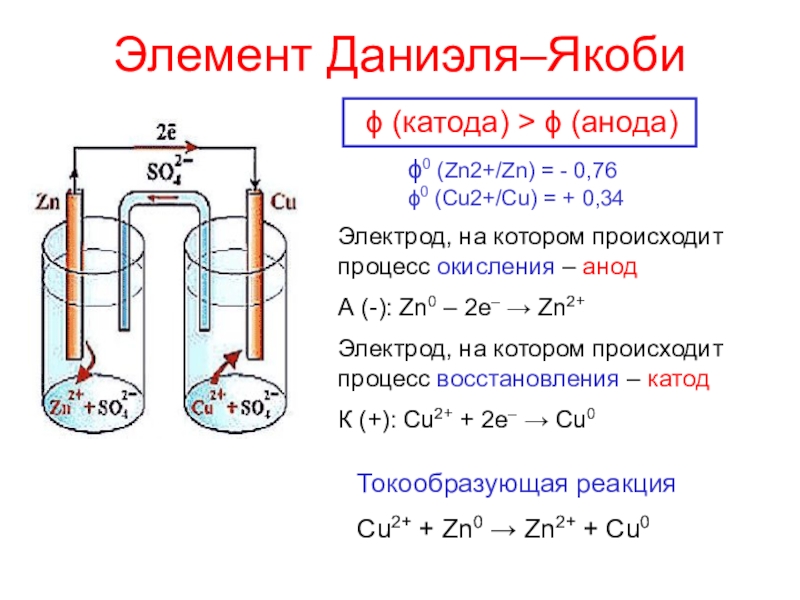
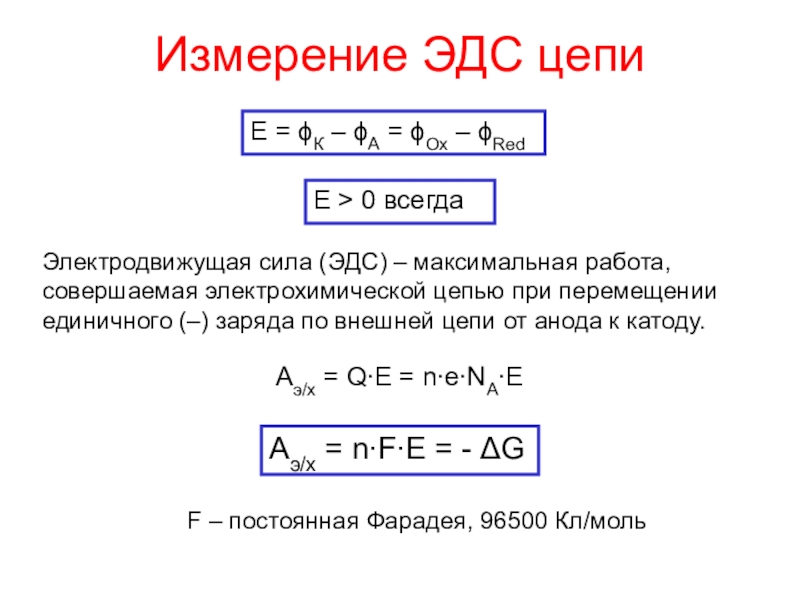
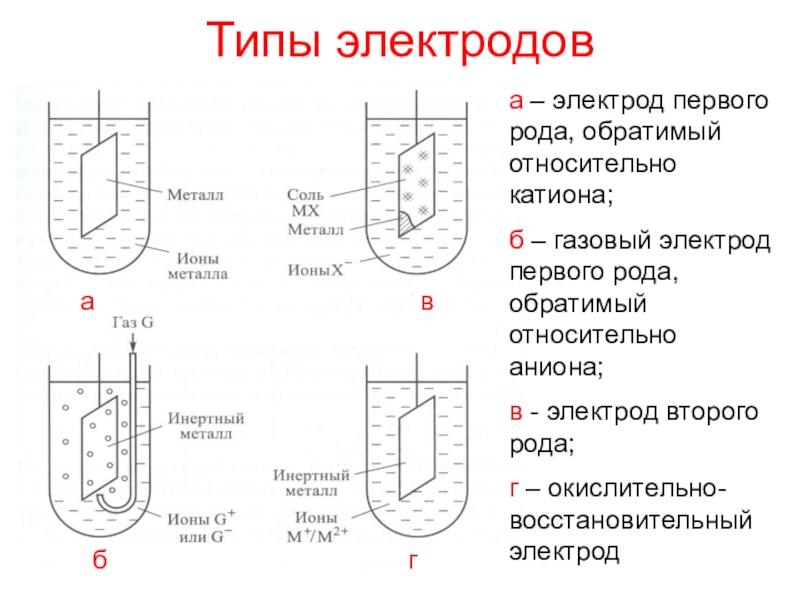
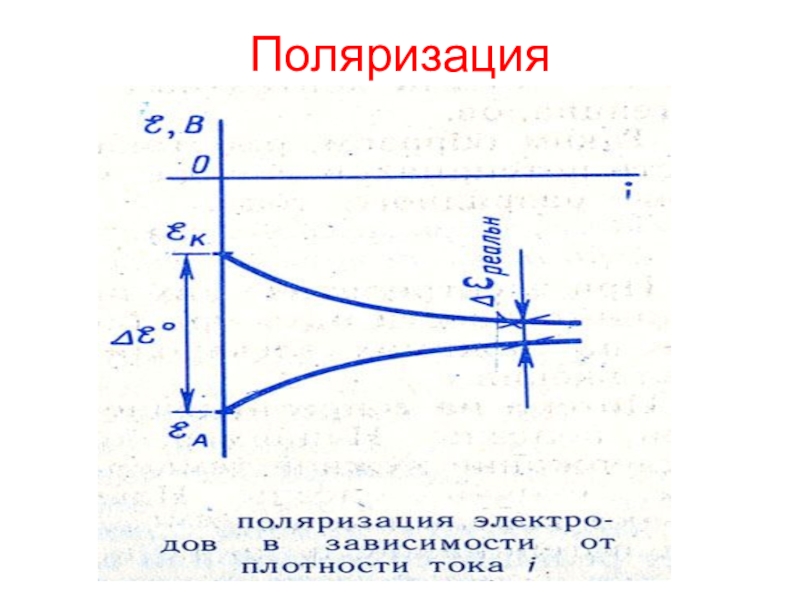
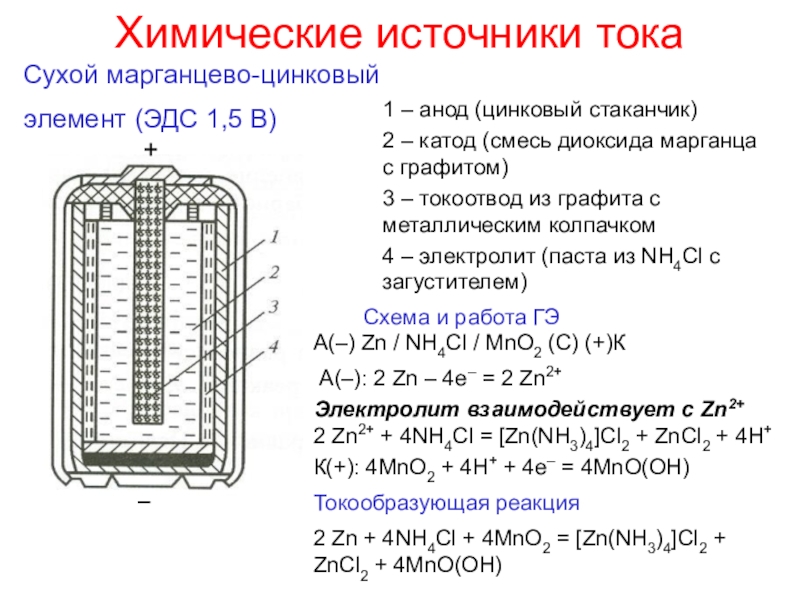
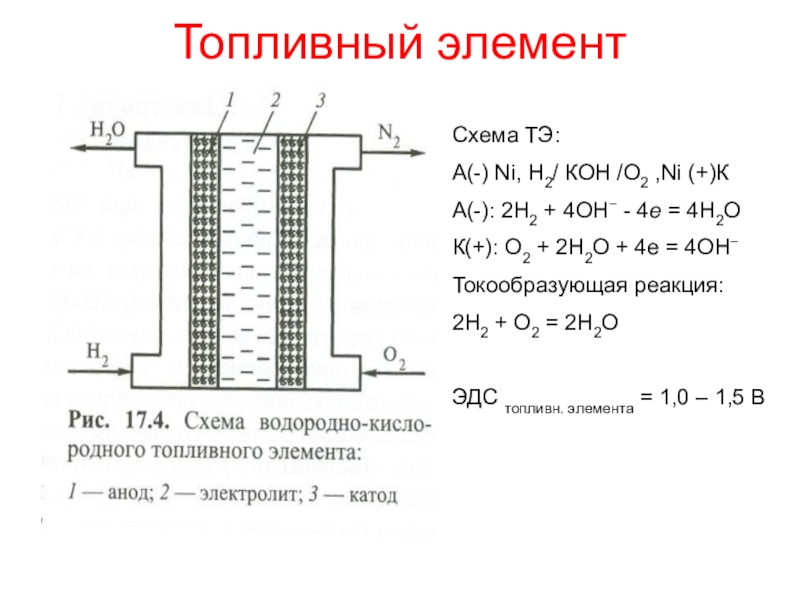
окисления атомов
Степень окисления (с.о.) – заряд, который приписывается атому,
считая его иономОкислитель (Ox) – принимает электроны.
Восстановитель (Red) – отдает электроны
Ox1 + Red2 Red1 +Ox2
Ox1 + ne– → Red1
Red2 – ne– →Ox2