Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
Содержание
- 1. ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
- 2. Актуальность исследованияДиагностика бычьего аденовируса затруднена из-за
- 3. Учитывая широкую распространенность респираторных
- 4. Цель диссертации: получение штаммов
- 5. Материалы и методы исследованияВ работе использованы штаммы
- 6. Препаративное разделение фрагментов ДНК и
- 7. Определение нуклеотидной последовательности ДНКПервичную структуру ДНК
- 8. Постановка иммуноблотингаЭлектрофорез антигена проводили в
- 9. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Дизайн
- 10. Рис. 2 - Схема
- 11. Получение генетической конструкции на
- 12. Рис. 3 - Электрофорез продуктов
- 13. Трансформация генетической конструкции и получение
- 14. Рис. 4 - Электрофорез продуктов ПЦР
- 15. Рис. 5 - ПААГ электрофорез
- 16. Выделение и очистка рекомбинантного гексона бычьего
- 17. Как следует из приведенных данных,
- 18. Рис. 6 - ПААГ электрофорез
- 19. В результате отработки параметров
- 20. ЗАКЛЮЧЕНИЕ
- 21. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
Вишенина Диана Вячеславовна
Научный руководитель:
Мукантаев Канатбек Найзабекович
Слайд 2
Актуальность исследования
Диагностика бычьего аденовируса затруднена из-за большого количества симптомов. Пневмоэнтериты
крупного рогатого скота аденовирусной этиологии необходимо дифференцировать от вирусной диареи,
респираторно-синцитиального вируса, ринотрахеита и парагриппа-3. Для обнаружения вируса применяют различные методы, такие как выделение вируса, гибридизация in situ, иммуноферментный анализ, иммунофлюоресценция, рестрикционный анализ и ПЦР. Однако, вышеперечисленные методы затратные по времени и требуют дорогостоящего оборудования и системы культуры ткани. В связи с этим, получение рекомбинантных антигенов вируса имеющих диагностическое значение является весьма актуальным.Слайд 3
Учитывая широкую распространенность респираторных и желудочно-кишечных болезней молодняка сельскохозяйственных животных
в Республике Казахстан, разработка современных экспресс тестов для выявления аденовирусной
инфекции, основанных на рекомбинантных антигенах вируса и моноклональных антителах является весьма актуальной для нашей страны.В диагностическом плане наибольший интерес представляют такие протеины вируса как гексон, пентон и филаментозная структура. При этом гексон является группоспецифическим белком и индуцирует образование группоспецифических антител.
Слайд 4
Цель диссертации: получение штаммов E.coli, продуцирующих рекомбинантный гексон бычьего аденовируса
3-го типа.
Для достижения цели научной работы были поставлены следующие
задачи:1. Дизайн генетической конструкции, несущей ген гексона бычьего аденовируса 3-го типа
2. Синтез гена гексона бычьего аденовируса и клонирование гена в экспрессионные плазмиды рЕТ32 и рЕТ28.
3. Трансформация компетентных клеток микроорганизмов полученными генетическими конструкциями.
4. Выделения и очистка рекомбинантного гексона бычьего аденовируса 3-го типа.
Новизна работы заключается в получении впервые в Казахстане рекомбинантного гексона бычьего аденовируса 3-го типа и разработке на его основе экспресс-теста для серологической диагностики болезней молодняка.
Теоретическая и практическая значимость. На основе полученных штаммов-продуцентов рекомбинантного гексона будут разработаны серологические экспресс-тесты для диагностики аденовирусных инфекций у крупного рогатого скота.
Слайд 5Материалы и методы исследования
В работе использованы штаммы Е. coli DH5cc,
BL21(DE3), плазмидный вектор pGEM-TEasy (Promega, USA), pET28, pET32. Клетки E.
coli выращивали в LB среде.Для синтеза гена гексона аденовируса крупного рогатого скота 3-го типа использованы олигонулеотиды синтезированные в условиях de novo.
Выделение и очистка плазмидной ДНК
Плазмидную ДНК выделяли из штамма E.coli DH5a методом щелочного лизиса. Очищали плазмидную ДНКметодом изопикнического центрифугирования.
Фракционирование фрагментов ДНК методом электрофореза в агарозном геле
Разделение фрагментов ДНК проводили согласно Маниатису и др. методом электрофореза в горизонтальных агарозных гелях.
Слайд 6
Препаративное разделение фрагментов ДНК и элюция их из геля
Препаративное разделение
фрагментов ДНК проводили в агарозном геле. Фрагменты выделяли из геля
методом электроэлюции.Лигирование фрагментов ДНК
Для лигирования фрагментов ДНК использовали ДНК-лигазу фага Т4. . Реакцию лигирования заканчивали после инкубирования в течение 45 минут при комнатной температуре.
Рестрикция ДНК
Гидролиз плазмидной ДНК проводили с использованием эндонуклеаз рестрикции NdeI, XhoI и BamHI.
Трансформация клеток E.coli
Для трансформации клеток лабораторных штаммов E.coli DH5α и XLBlue использовали метод Ханахана.
Слайд 7
Определение нуклеотидной последовательности ДНК
Первичную структуру ДНК определяли по методу Сэнгера.
Трансформация и экспрессия гетерологичного белка
Трансформацию компетентных клеток BL21 плазмидными векторами
рЕТ-28 и рЕТ-32 со вставками генов проводили методом электропорации. Трансформированные клетки были инкубированы в течение 1 часа при интенсивном встряхивании. Затем клетки высевали на агаризованную среду с антибиотиком в качестве селектирующего фактора и растили при +37°C в течение 16 часов.. Сбор клеток осуществляли центрифугированием в течение 7 минут.Лизирование и хроматографическая очистка
Лизирование клеток осуществляли с использованием ультразвукового дезинтегратора. Очистку белка осуществляли металлохелатной хроматографией
Электрофорез
Электрофоретическое разделение белков проводили по методу Лэммли в полиакриламидном геле.
Слайд 8
Постановка иммуноблотинга
Электрофорез антигена проводили в полиакриламидном геле по методу Лэмли
на аппарате для вертикального электрофореза. Электрофоретический перенос антигенов из геля
на нитроцеллюлозную мембрану осуществляли с помощью прибора для иммуноблотинга. Для иммунохимического проявления специфических антигенов нитроцеллюлозную мембрану сначала инкубировали в течение ночи при 4оС.Затем отмывали по три раза и выдерживали в растворе моноклональных антител, После чего носитель вновь отмывали и инкубировали в рабочем разведении антивидовых антител, меченных пероксидазой.
Тандемная масс-спектрометрия (nanoLC-MS/MS)
????????????
Слайд 9 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Дизайн и синтез генетической
конструкции, несущей ген фрагмента N-терминальной части гексона бычьего аденовируса
В
результате проведенного дизайна, на основе pET28 и pET32 плазмид, были разработаны две генетические конструкции, несущих ген фрагмента N-терминальной части гексона аденовируса крупного рогатого скота 3-го типа.Экспрессионный регион плазмидного вектора pET28 вместе со встроенным геном включает гены 6His-Tag, тромбиновый сайт, ген фрагмента N-терминальной части гексона вируса и 6His-Tag. Прогнозируемая молекулярная масса рекомбинантного белка экспрессируемая плазмидой составляет 24 кДа.
В отличие от вектора pET28 экспрессионный регион плазмидного вектора pET32 включает гены тиоридоксинового белка, His-Tag, S-Tag, тромбина и энтерокиназы, His и S меток после выделения и очистки белка, гена фрагмента гексона и 6His-Tag.
Слайд 10
Рис. 2 - Схема генетической конструкции на основе pET32 плазмиды
несущей ген фрагмента N-терминальной части гексона бычьего аденовируса 3-го типа
Рис.
1 - Схема генетической конструкции на основе pET28 плазмиды несущей ген фрагмента N-терминальной части гексона бычьего аденовируса 3-го типаСлайд 11
Получение генетической конструкции на основе вектора pET28 и Рет32, несущей
ген фрагмента N-терминальной части гексона бычьего аденовируса
На основе отобранной аминокислотной
последовательности фрагмента N-терминальной части гексона аденовируса крупного рогатого скота получена нуклеотидная последовательность, оптимизированная для экспрессии в кишечной палочке.К полученному гену фрагмента N-терминальной части гексона аденовируса крупного рогатого скота со стороны 3’конца добавлена последовательность гексогистидиновой метки за которой следуют сайты для Xho и HindIII рестриктаз. Со стороны 5’-конца достроены сайты NcoI, EcorI и BamHI рестриктаз.
Синтез гена проводили методом двух раундовой полимеразной цепной реакцией. Молекулярная масса полученного продукта составляет 500 пар оснований, что соответствует прогнозируемой длине гена.
Слайд 12
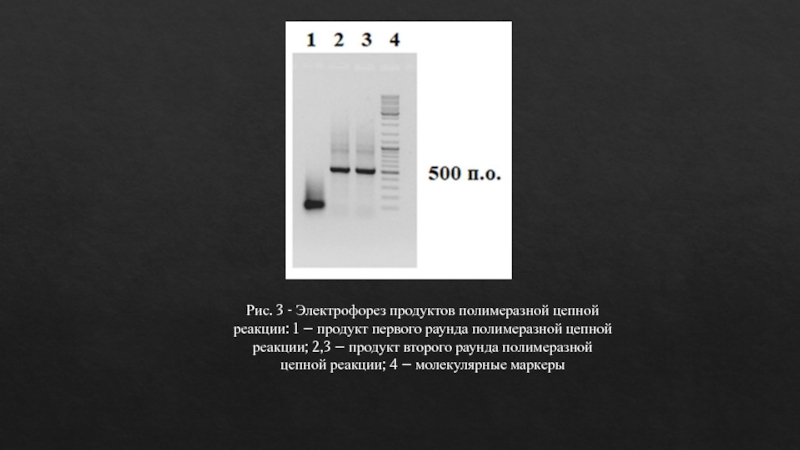
Рис. 3 - Электрофорез продуктов полимеразной цепной реакции: 1 –
продукт первого раунда полимеразной цепной реакции; 2,3 – продукт второго
раунда полимеразной цепной реакции; 4 – молекулярные маркерыСлайд 13
Трансформация генетической конструкции и получение стабильных штаммов микроорганизмов, продуцентов рекомбинантного
гена фрагмента N-терминальной части гексона аденовируса.
Полученный ген фрагмента N-терминальной части
гексона бычьего аденовируса 3-го типа по сайтам рестрикции BamHI и HindIII клонирован в экспрессионную плазмиду pET28. По сайтам рестрикции NcoI и XhoI полученный ген клонирован в экспрессионную плазмиду pET32. Полученные конструкции трансформированы методом электропорации в экспрессионные штаммы E.coli BL21 и высевались на среду LB с содержанием антибиотика канамица для pET28 вектора и ампицилина для pET32 вектора.
Колонии клеток скринировались на наличие экспрессионных векторов, несущих ген фрагмента гексона бычьего аденовируса 3-го типа.
Результаты скрининга показали высокую эффективность трансформации. До 80% клонов несли плазмиды со вставками гена фрагмента гексона бычьего аденовируса 3-го типа.
Слайд 14
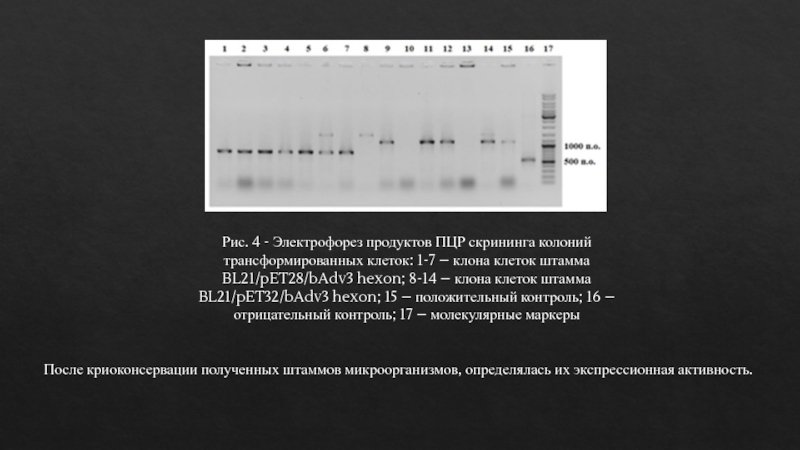
Рис. 4 - Электрофорез продуктов ПЦР скрининга колоний
трансформированных клеток:
1-7 – клона клеток штамма BL21/pET28/bAdv3 hexon; 8-14 – клона
клеток штамма BL21/pET32/bAdv3 hexon; 15 – положительный контроль; 16 – отрицательный контроль; 17 – молекулярные маркерыПосле криоконсервации полученных штаммов микроорганизмов, определялась их экспрессионная активность.
Слайд 15
Рис. 5 - ПААГ электрофорез белков при определении экспрессионной
активности штамм-продуцентов BL21/pET32/bAdv3 hexon (А) и BL21/pET28/bAdv3 hexon (Б): 1
– культура клеток без ИПТГ; 2 – 2 часа инкубирования с ИПТГ; 3 – 4 часов инкубирования с ИПТГ; 4 – 6 часов с ИПТГ; 5 – 12 часов с ИПТГ;6 – молекулярные маркеры
Штамм-продуцент E.coli BL21/pET28/bAdv3hexon производил белок молекулярной массой 24 кДа. Штамм E.coli BL21/pET32/bAdv3hexon производил белок молекулярной массой 34 кДа.
Слайд 16
Выделение и очистка рекомбинантного гексона бычьего аденовируса
Для оптимизации выделения и
очистки рекомбинантного гексона штаммы-продуценты культивировались в следующих условиях: концентрации индуктора
0,1 мМ, 0,25 мМ, 0,5 мМ, 1 мМ; температуры питательной среды 250С и 370С. При этом результаты эксперимента оценивались по относительному содержанию рекомбинантных белков в нерастворимой фракции лизатов штамма-продуцента.Относительные количества рекомбинантных белков (%) в нерастворимых фракциях лизатов штаммов-продуцентов при различных условиях индукции экспрессии
Таблица 1
Слайд 17
Как следует из приведенных данных, для всех выбранных для дальнейшей
работы штаммов-продуцентов максимальная продукция рекомбинантных белков в растворимой фракции отмечена
при следующих условиях культивирования: концентрация индуктора 0,2 мМ, температура культивирования после индукции экспрессии 250С.В следствии того, что рекомбинантный белок экспрессировался в тельца включения, важным параметром очистки является оптимальная концентрация мочевины в денатурирующем буфере. При определении оптимального денатурирующего буфера использовались различные концентрации мочевины. Из рисунка видно, что наиболее эффективным является 8 М мочевина.
Слайд 18
Рис. 6 - ПААГ электрофорез белков после денатурации мочевиной: 1
–осадок после разрушения клеток; 2 – над осадочная жидкость после
разрушения клеток; 3 – 1М мочевина; 2 - 4М мочевина; 5 – 8М мочевина; 6 – 2 М мочевина; 7 – молекулярные маркерыСлайд 19
В результате отработки параметров выделения и очистки рекомбинантных белков были
получены очищенные препараты антигенов. Для очистки рекомбинантных белков использовали металлхелатную
хроматографию на основе никель-сефарозы. В качестве эллюирующего буфера использовали буфер с содержанием различных концентраций имидазола. Электрофоретический анализ показал чистые препараты белка молекулярной массой 24 кДаРис.7 - ПААГ электрофорез белков после хроматографической очистки: 1-3 – 200 мМ имидазол; 4 – молекулярный маркер; 5-7 – 500 мМ имидазол