Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Процессинг (созревание) РНК. Биосинтез белка и его регуляция. Мутации
Содержание
- 1. Процессинг (созревание) РНК. Биосинтез белка и его регуляция. Мутации
- 2. Процессинг включает 3 основных этапа Модификация
- 3. 2. Модификация 3’-конца (полиаденилирование): с
- 4. Основное значение «кэпа» и полиаденилового «хвоста» –
- 5. Кроме того:«Кэп» обеспечивает связывания мРНК с рибосомой
- 6. Ген эукариот имеет мозаичную структуру: содержит информативные нуклеотидные последовательности - экзоны и неинформативные - интроны
- 7. 3. Сплайсинг – вырезание интронов и сшивание экзонов
- 8. На 5’- и 3’-концах интронов имеются сайты
- 9. мяРНП сплайсосомы катализируют расщепление 3’,5’-фосфодиэфирной связи на границе экзона
- 10. Сплайсинг РНК
- 11. Сплайсосома расщепляет 3’,5’-фосфодиэфирную связь на границе экзона с интроном
- 12. Процессинг пре-мРНК
- 13. пре-мРНК (около 5000 НТ) после сплайсинга превращаются в более короткие молекулы (500-3000 НТ )
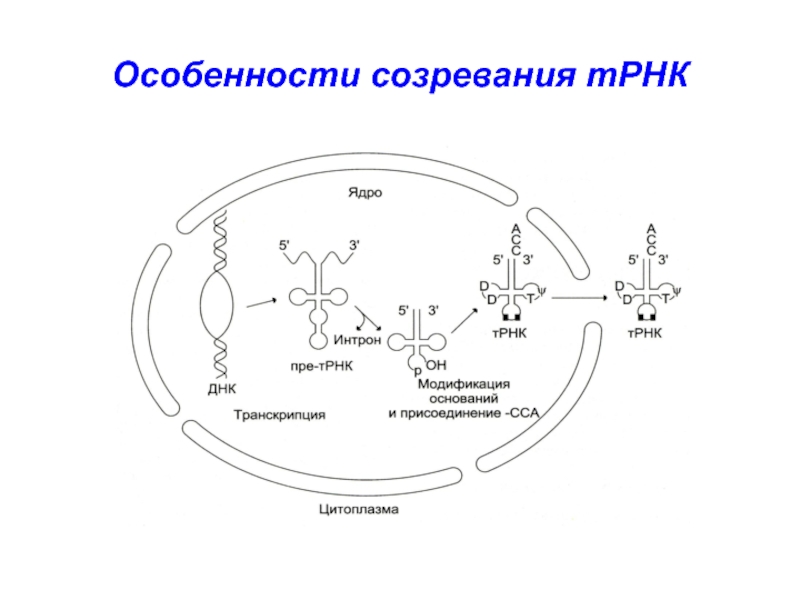
- 14. Особенности созревания тРНК
- 15. тРНК сильно метилируется, на 3’-конце у всех
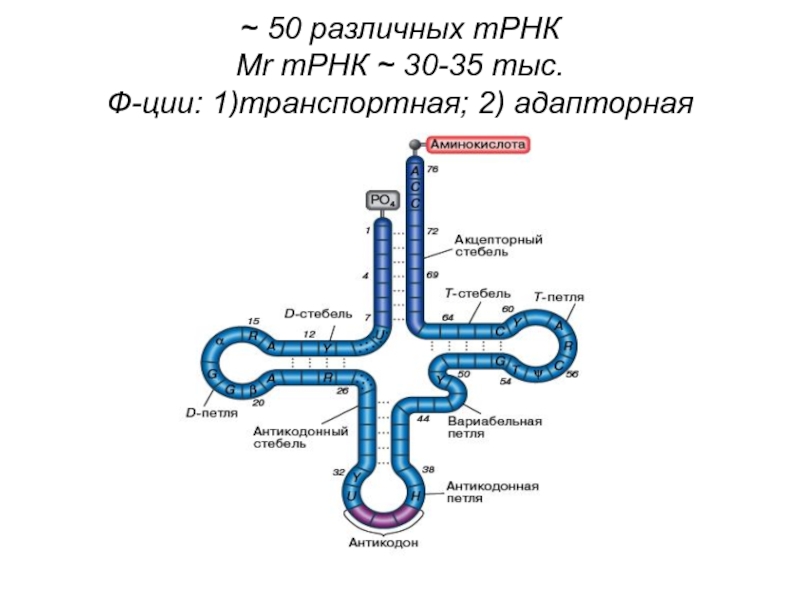
- 16. ~ 50 различных тРНК Мr тРНК ~ 30-35 тыс. Ф-ции: 1)транспортная; 2) адапторная
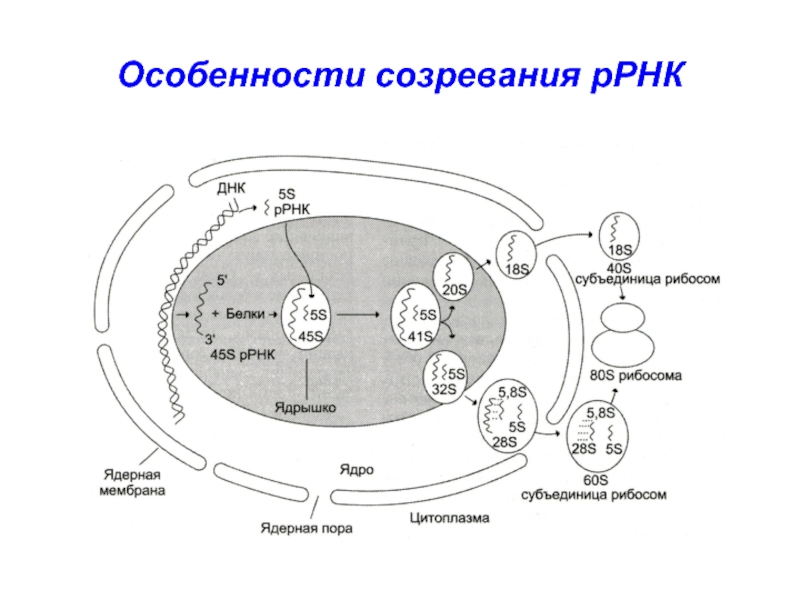
- 17. Особенности созревания рРНК
- 18. рРНК (45S) прежде чем покинуть ядро в
- 19. Рибосома эукариот (80S) состоит из двух субъединиц:
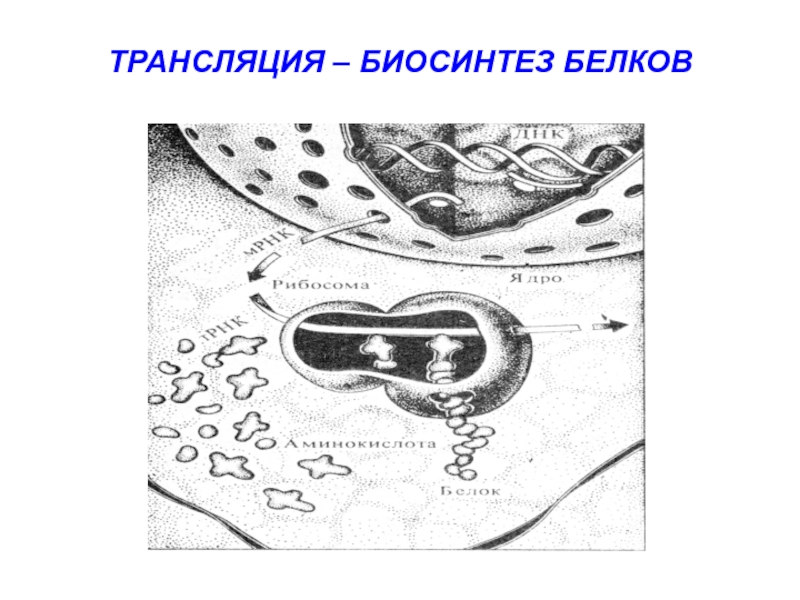
- 20. ТРАНСЛЯЦИЯ – БИОСИНТЕЗ БЕЛКОВ
- 21. М. Ниренберг, Г. Маттеи в 60-х
- 22. Свойства генетического кода1. Триплетность: одна аминокислота кодируется
- 23. 2. Неперекрываемость – один и тот же
- 24. 6. Вырожденность – каждая аминокислота кодируется несколькими
- 25. Выделяют два этапа трансляцииРекогниция Собственно трансляция: - инициация - элонгация - терминация
- 26. Рекогниция - узнавание аминокислотРеакция происходит с
- 27. Слайд 27
- 28. тРНК
- 29. Собственно трансляция: 1 - инициацияОбразование инициирующего комплекса:
- 30. Метионил-тРНК своим антикодоном связывается с инициирующим кодоном
- 31. С затратой энергии ГТФ к этому комплексу
- 32. Слайд 32
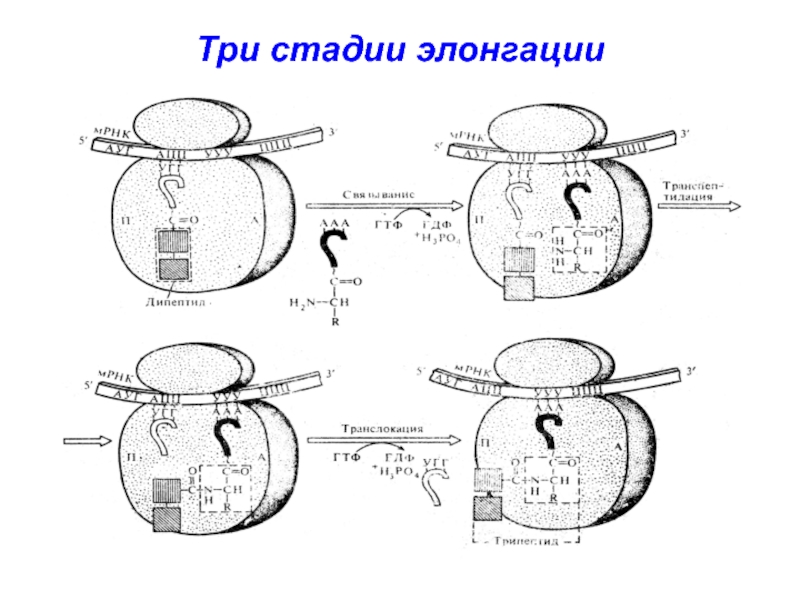
- 33. Три стадии элонгации
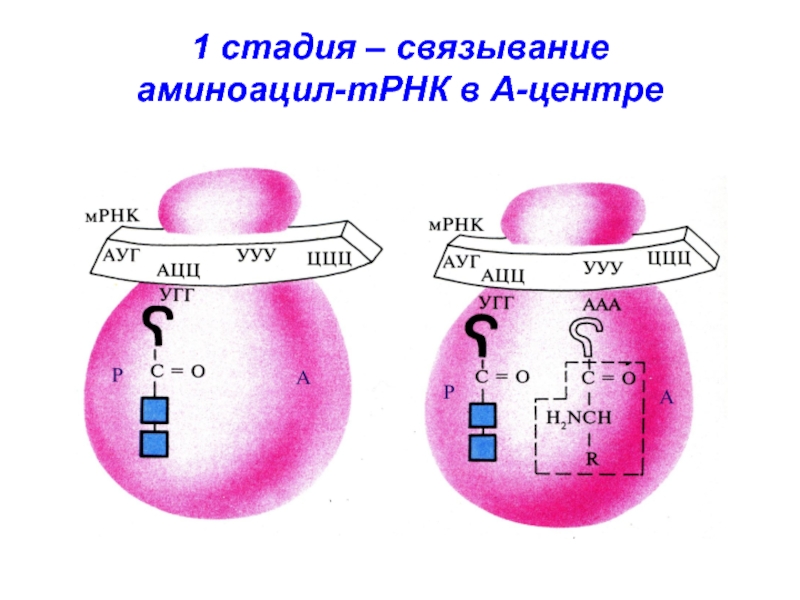
- 34. 1 стадия – связывание аминоацил-тРНК в А-центре
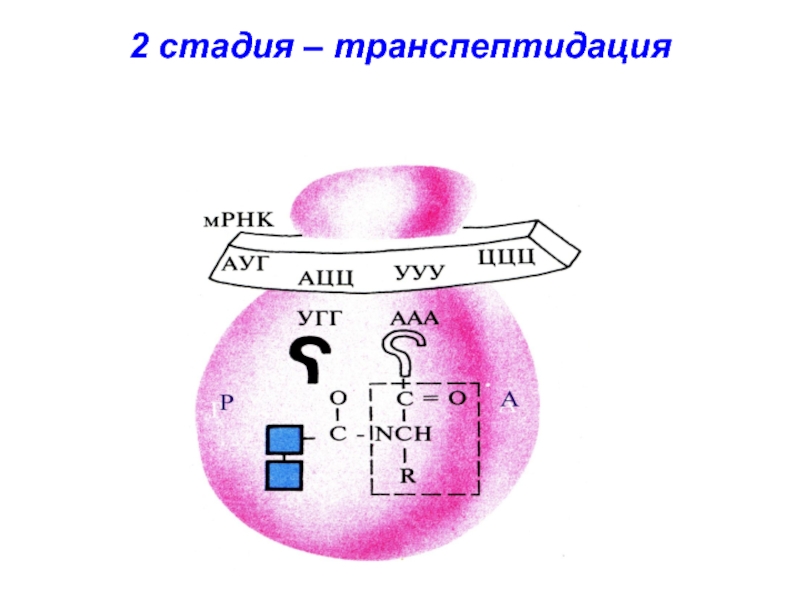
- 35. 2 стадия – транспептидация
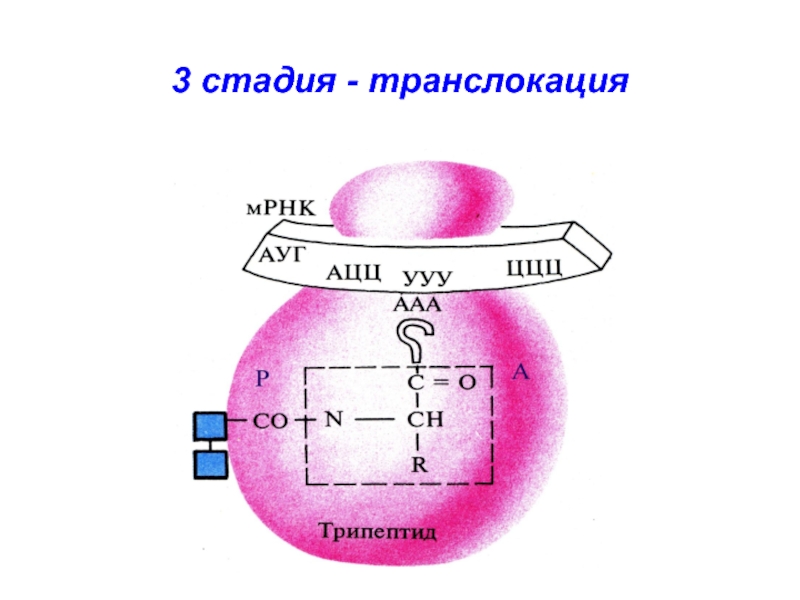
- 36. 3 стадия - транслокация
- 37. 3 - терминация Синтез полипептида заканчивается, когда в
- 38. Посттрансляционная модификация Удаляются ненужные участки, происходят реакции метилирования,
- 39. 2 класса специальных белков:1 – специальные ферменты:
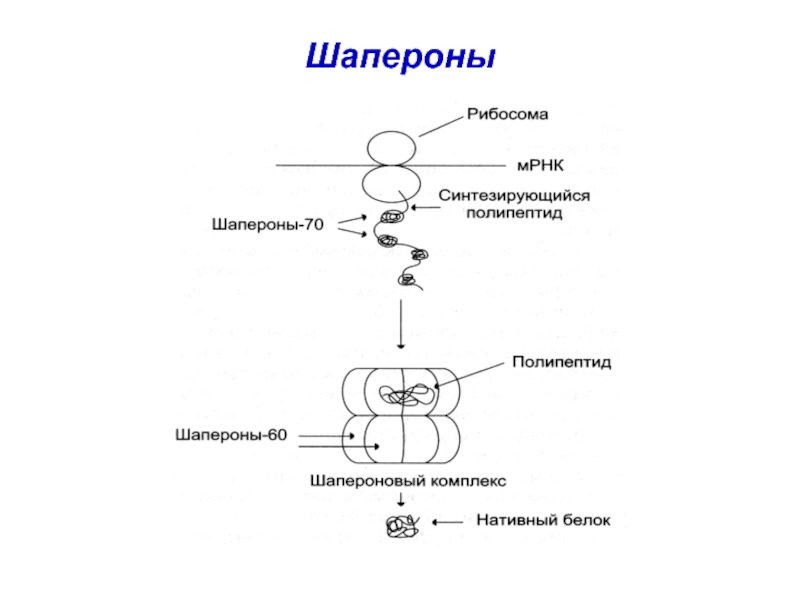
- 40. 2 – «шапероны» - белки, помогающие новосинтезируемому белку быстро найти правильную пространственную ориентацию
- 41. Задача шаперонов (ШП)– защита нового белка от
- 42. Впервые ШП были обнаружены при перегреве организма
- 43. Шапероны
- 44. Нарушение фолдинга → заболевания ЦНС Нормальные белки
- 45. Примеры заболеванийПрионовые болезни: «коровье бешенство» -болезнь Кройтцфельдта-Якоба,
- 46. Болезнь Альцгеймера – β-амилоидоз нервной системы, поражающий
- 47. Регуляция биосинтеза белка В 1961 г. французские исследователи
- 48. Теория оперона
- 49. Координированный одним оператором одиночный ген или группа
- 50. Репрессор блокирует ген-оператор → оперон не работает
- 51. Вещества, которые инактивируют репрессор, называются индукторами Вещества,
- 52. Лактоза – индуктор, присоединяясь к белку-репрессору, переводит
- 53. 3 фермента, участвующие в метаболизме лактозы: β-галактозидаза β-галактозидпермеаза β-галактозидацетилаза
- 54. После распада лактозы белок-репрессор переходит снова в
- 55. ДНК всех клеток организма идентична;
- 56. Энхансеры – участки ДНК размером 10-20
- 57. Регуляция транскрипции Промоторы генов эукариот находятся под контролем специфических
- 58. К регуляторным участкам присоединяются комплексы белков с
- 59. С энхансерами взаимодействуют индукторыС сайленсорами - репрессорыЭто
- 60. У эукариотов ведущая роль в экспрессии генов
- 61. Геном человека содержит 3,5 млрд пар нуклеотидов Только ~10% из них несут информацию
- 62. Количество генов у человека 30 тысяч,
- 63. 4 – гены, кодирующие структурные белки и
- 64. Скачать презентанцию
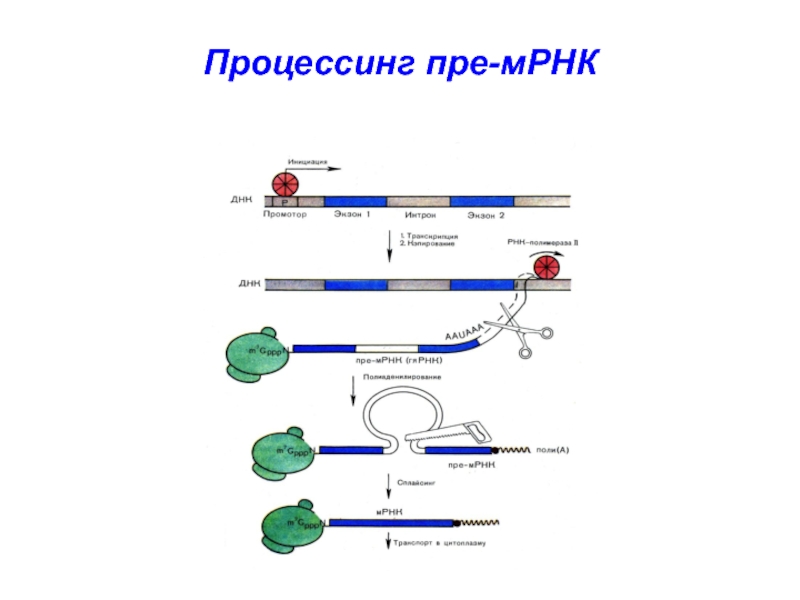
Процессинг включает 3 основных этапа Модификация 5’-конца (кэпирование): образование 7-метил-ГТФ («кэп» или «колпачок»)(результат действия фермента гуанилилтрансферазы и процесс метилирования остатка гуанина)
Слайды и текст этой презентации
Слайд 1Процессинг (созревание) РНК.
Биосинтез белка и его регуляция. Мутации.
Кафедра биологической химии
Слайд 2Процессинг включает
3 основных этапа
Модификация 5’-конца (кэпирование):
образование 7-метил-ГТФ
(«кэп» или «колпачок»)
(результат действия фермента
гуанилилтрансферазы и процесс метилирования остатка
гуанина)Слайд 3 2. Модификация 3’-конца (полиаденилирование):
с помощью фермента
полиА-полимеразы
формируется полиадениловая последовательность на 3’ конце
– АААА....-ОН -
полиадениловый «хвост» –
100-200 нукл. остатков
Слайд 4
Основное значение «кэпа» и полиаденилового «хвоста» –
защита РНК от
расщепления
экзонуклеазами
по «дороге» из ядра в цитоплазму
Слайд 5Кроме того:
«Кэп» обеспечивает связывания мРНК с рибосомой при инициации трансляции
и необходим для работы ферментатив. системы, обеспечивающей удаление интронов
Полиадениловый «хвост»
облегчает выход мРНК из ядра и замедляет ее гидролиз в цитоплазмеСлайд 6 Ген эукариот имеет мозаичную структуру:
содержит информативные нуклеотидные последовательности -
экзоны
и
неинформативные -
интроны
Слайд 7
3. Сплайсинг – вырезание интронов
и сшивание экзонов с помощью
малых
ядерных рибонуклеопротеинов - мяРНП , содержащих мяРНК и олигомерный белок.
мяРНК - рибозимыСлайд 8
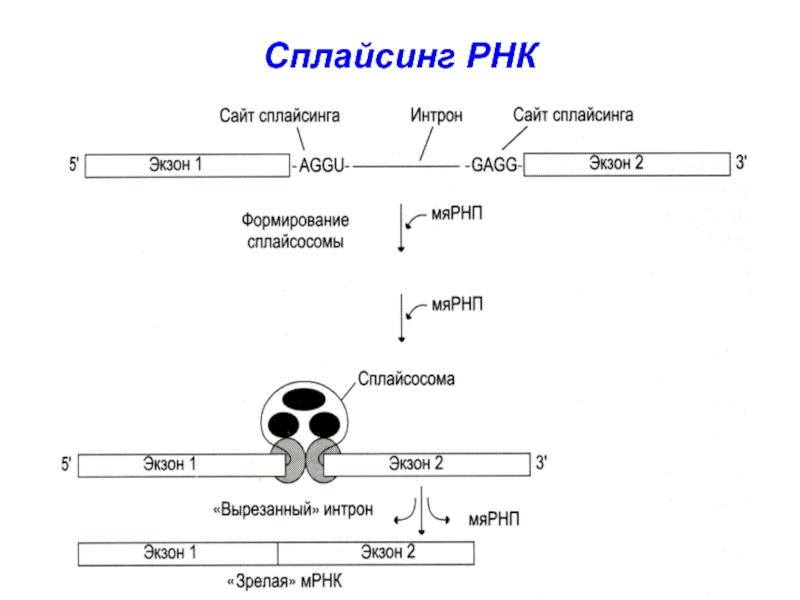
На 5’- и 3’-концах интронов имеются
сайты сплайсинга – -АГГУ-
и -ГАГГ-
С ними связываются мяРНП
и формируется сплайсосома
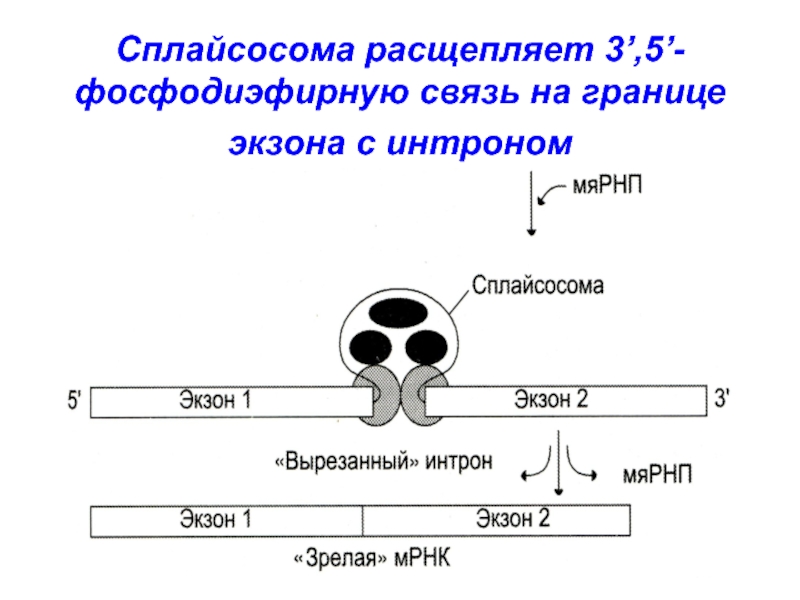
Слайд 9мяРНП сплайсосомы катализируют
расщепление 3’,5’-фосфодиэфирной
связи на границе экзона с интроном
Интрон удаляется,
а два экзона соединяются «конец в конец»
мяРНП сплайсосомы катализируют
образование
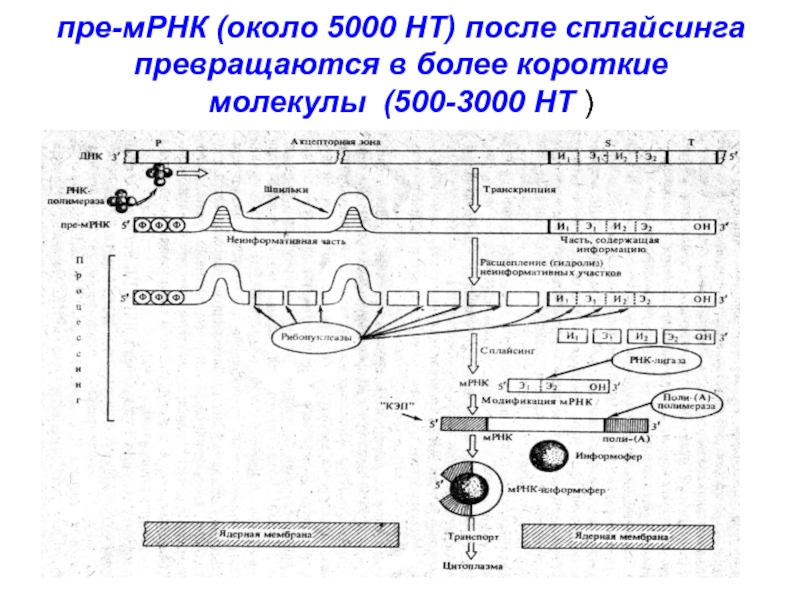
3’,5’-фосфодиэфирной связи между двумя экзонамиСлайд 13пре-мРНК (около 5000 НТ) после сплайсинга превращаются в более короткие
молекулы (500-3000 НТ )
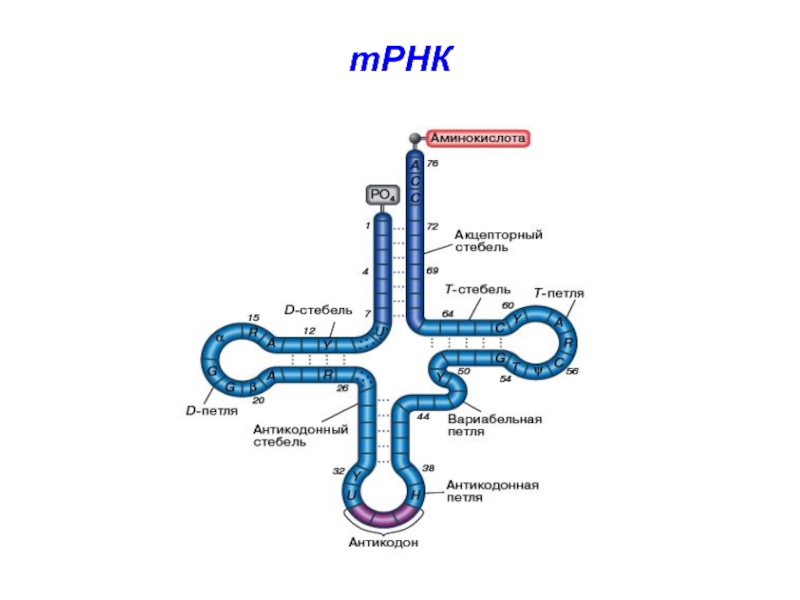
Слайд 15тРНК сильно метилируется,
на 3’-конце у всех тРНК – ЦЦА
(акцепторный конец)
пре-тРНК содержит всего 1 интрон, состоящий из 14-16 нуклеотидов.
в результате сплайсинга тРНК формируется «антикодон» - триплет нуклеотидов, обеспеч. взаимодействие с комплементарным кодоном в ходе синтеза белка
Слайд 18рРНК (45S) прежде чем покинуть ядро в составе рибосомной частицы,
подвергается процессингу, в результате которого образуются субчастицы - компоненты рибосом:
28S
рРНК (около 5000 нуклеотидов), 18S рРНК (около 2000 нуклеотидов) и 5,8S рРНК (около 160 нуклеотидов)Слайд 19Рибосома эукариот (80S)
состоит из двух субъединиц:
большой – 60S
(5S; 5,8S; 28S рРНК и
49 различных белков)
и малой -
40S (18S рРНК и 33 молекулы белков)Функции белков рибосом:
- структурная
- регуляторная
- каталитическая
Слайд 21М. Ниренберг, Г. Маттеи
в 60-х гг. XX века
Синтезировали полипептиды
определенного строения, используя различные матрицы:
Поли-У → полифенилаланин;
Поли-Ц → полипролин;Поли-Г → полиглицин.
УУУ → фен; ЦЦЦ → про; ГГГ → гли.
Определили смысл кодонов.
Установили, что из 64 кодонов:
61 – несут информацию;
3 (УАА, УАГ, АГА) – нонсенс-кодоны → стоп-кодоны.
Слайд 22Свойства генетического кода
1. Триплетность: одна аминокислота кодируется последовательностью из трех
нуклеотидов – кодоном или триплетом. Число кодирующих последовательностей из 4
нуклеотидов по 3 равно 43=64, что более чем в 3 раза превышает количество, необходимое для кодирования 20 АК.Слайд 232. Неперекрываемость – один и тот же нуклеотид не может
одновременно входить в два кодона.
3. Однонаправленность – код считывается всегда
в направлении 5’→3’.4. Непрерывность – код считывается без запятых и без пропусков.
5. Специфичность – каждый триплет кодирует только одну определенную аминокислоту.
Слайд 246. Вырожденность – каждая аминокислота кодируется несколькими кодонами, что является
необходимым для повышения устойчивости к мутациям.
7. Универсальность – код универсален
для всех изученных организмов. Исключение: митохондриальная мРНК содержит 4 триплета, имеющих другое значение, чем ядерная мРНК.
Слайд 25Выделяют два этапа трансляции
Рекогниция
Собственно трансляция:
- инициация
- элонгация
- терминация
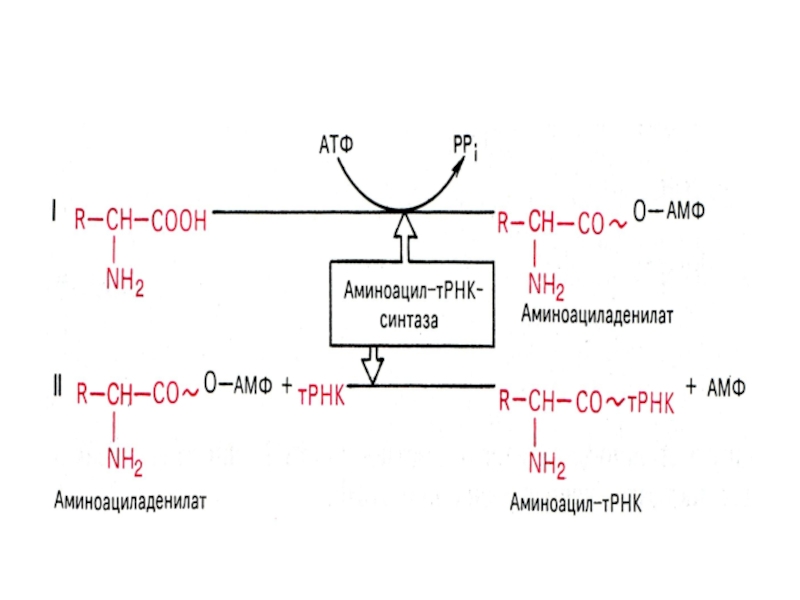
Слайд 26Рекогниция -
узнавание аминокислот
Реакция происходит с помощью ферментов – аминоацил-тРНК-синтетаз
(аа-тРНК-синтетаз) -
20 по числу протеиногенных АК
функции аа-тРНК-синтетаз :
1 -
специфически узнают тРНК и АК;2 - катализируют активацию АК;
3 - переносят АК на т-РНК
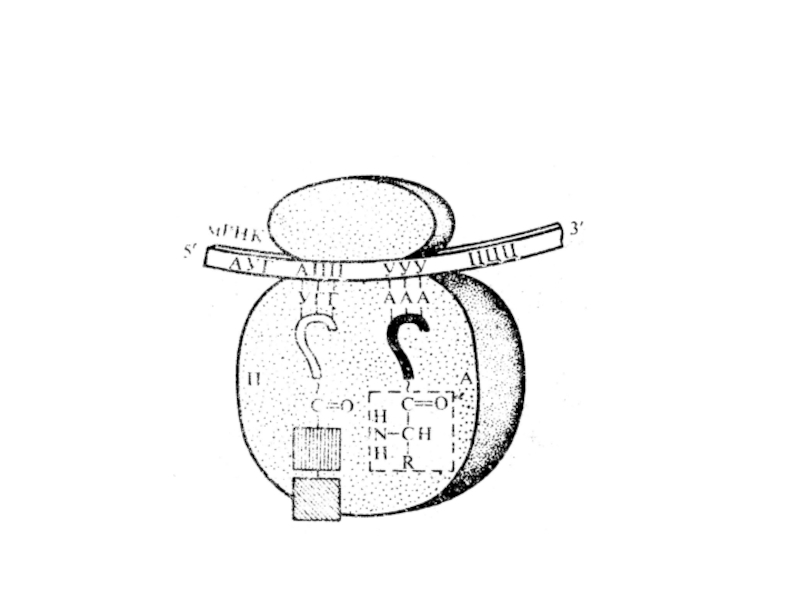
Слайд 29Собственно трансляция: 1 - инициация
Образование инициирующего комплекса: рибосома, мРНК, инициирующая
метионил-тРНКi
Участвуют специальные белки – факторы инициации (еIF) (не < 10)
С
малой субъединицей рибосомы взаимодействуют еIF-3, что стимулирует объединение с еIF-2, мет-тРНКiмет и ГТФЭтот комплекс связывается с 5’-концом мРНК при участии неск. еIF (узнавание «кэпа») .
С затратой энергии АТФ 40S скользит по мРНК
5’→ 3’ 40-80 нукл. до первого кодона мРНК у 5’-конца инициирующий кодон: АУГ
Этому кодону соответствует инициирующая метионил-тРНКi
Слайд 30Метионил-тРНК своим антикодоном связывается с инициирующим кодоном мРНК -
как бы «подвешивается» на водородных связях к мРНК
При этом акцепторный конец в дальнейшем прикрепляется к большой субъединице рибосом
Слайд 31С затратой энергии ГТФ
к этому комплексу присоединяется большая субъединица
рибосомы с участием других факторов инициации и формируются 2 центра:
пептидильный
(Р);аминоацильный (А),
занимающие расстояние в 2 кодона
Слайд 373 - терминация
Синтез полипептида заканчивается, когда в А-участок поступает один
из терминирующих кодонов –
УАА, УАГ, УГА
Эти сигналы воспринимаются
2
специальными белками – релизинг-факторами (RF) или факторами терминации ,
которые останавливают элонгацию
Слайд 38Посттрансляционная модификация
Удаляются ненужные участки, происходят реакции метилирования, гликозилирования, фосфорилирования, иодирования,
карбиксилирования, ацилирования, гидроксилирования, окисления, образование дисульфидных связей, удаление некоторых АК,
фолдинг – укладка белка в пространстве (формирование вторичной, третичной структуры)Слайд 392 класса специальных белков:
1 – специальные ферменты:
- дисульфидизомеразы –
формируют правильные дисульфидные связи и корректируют нативную структуру белка
-
пролинизомеразы – катализируют цис-транс изомеризацию пептидных связей про Слайд 402 – «шапероны» - белки, помогающие новосинтезируемому белку быстро найти
правильную пространственную ориентацию
Слайд 41Задача шаперонов (ШП)– защита нового белка от действия различных ферментов
при
повреждении клетки ШП связывают частично денатурирующие белки, стабилизируют их структуру,
препятствуют их агрегации и осаждениюСлайд 42Впервые ШП были обнаружены при перегреве организма → белки теплового
шока
ШП много в функционально активных тканях: эмбриональной, лимфатической, яичников и
т.д. Слайд 44Нарушение фолдинга → заболевания ЦНС
Нормальные белки обретают неправильную 2,3,4
структуру,
много β-складчатых структур
Образуются макромолекулярные агрегаты – амилоидные бляшки
Слайд 45Примеры заболеваний
Прионовые болезни: «коровье бешенство» -болезнь Кройтцфельдта-Якоба, куру
прионы - класс
белков, обладающих инфекционными свойствами: попадая в организм человека или спонтанно
возникая в нем, вызывают неизлечимые заболевания ЦНССлайд 46Болезнь Альцгеймера – β-амилоидоз нервной системы, поражающий лиц преклонного возраста.
Характеризуется прогрессирующим расстройством памяти, приводящим к полной деградации личности.
Слайд 47Регуляция биосинтеза белка
В 1961 г. французские исследователи Франсуа Жакоб и
Жак Моно предложили
теорию Lac-оперона, которая объясняла механизм контроля синтеза
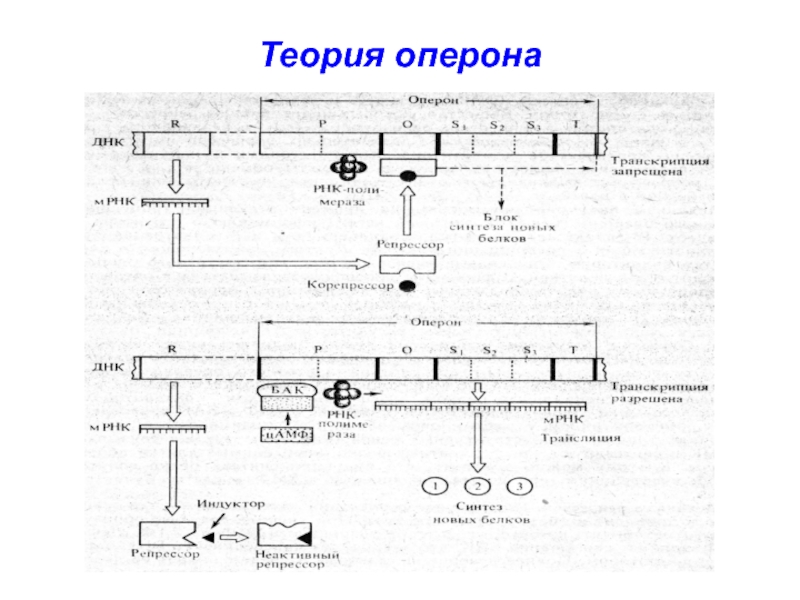
белков у прокариотовСлайд 49Координированный одним оператором одиночный ген или группа генов образуют оперон.
Lac
-оперон - участок ДНК, в котором закодированы ферменты, участвующие в
усвоении лактозы.О (ген-оператор) – ген, управляющий работой структурных генов.
R (ген-регулятор) – ген, кодирующий синтез специального регуляторного белка – репрессора.
Слайд 50Репрессор блокирует ген-оператор → оперон не работает → транскрипция мРНК
не происходит → синтез белка не идет
Способность связываться с оператором
зависит от конформации репрессора, которая может быть активной или неактивной Слайд 51Вещества, которые инактивируют репрессор, называются индукторами
Вещества, переводящие его из
неактивного состояния в активное – корепрессорами
Слайд 52Лактоза – индуктор, присоединяясь к белку-репрессору, переводит его в неактивную
форму, не способную связываться с О.
РНК-полимераза связывается с Р
и транскрибирует структурные гены: S1, S2, S3, несущие информацию о ферментах метаболизма лактозы → транскрипция мРНК → синтез ферментов Слайд 533 фермента, участвующие в метаболизме лактозы:
β-галактозидаза
β-галактозидпермеаза
β-галактозидацетилаза
Слайд 54После распада лактозы белок-репрессор переходит снова в активную форму, способную
связываться с О.
Т.к. участки О и Р перекрываются, то присоединение
репрессора к О препятствует связыванию РНК-полимеразы с Р, → транскрипция мРНК не идет → синтез ферментов прекращается Слайд 55
ДНК всех клеток организма идентична;
>200 различных типов клеток
Гены «домашнего хозяйства»
~ 20%
Адаптивно регулируемые гены
Регуляция транскрипции
осуществляется при помощи
специальных регуляторных
элементов –локусов - участков генома –энхансеров и сайленсеров
Слайд 56 Энхансеры – участки ДНК размером 10-20 пар оснований, присоединение
к которым регуляторных белков активирует РНК-полимеразу и увеличивает скорость транскрипции
Сайленсеры – таких же разметов участки ДНК, присоединение к которым регуляторных белков ингибирует РНК-полимеразу и замедляет транскрипцию Слайд 57Регуляция транскрипции
Промоторы генов эукариот находятся
под контролем специфических
регуляторных участков на
молекуле ДНК:
ТАТА-, ЦААТ-, ГЦ-,
энхансеров, сайленсеров –
последовательностей
Слайд 58 К регуляторным участкам
присоединяются
комплексы белков
с различными лигандами:
цАМФ,
стероидными
гормонами, метаболитами,
ионами металлов и т.д.
Слайд 59С энхансерами взаимодействуют индукторы
С сайленсорами - репрессоры
Это сложные белки, имеющие
несколько доменов:
«узнает» локус;
«узнает» регуляторную молекулу (фактор роста, цАМФ, стероид-рецепторный комплекс
и др.);«узнает» факторы транскрипции в
ТАТА - последовательности
Слайд 60
У эукариотов ведущая роль в экспрессии генов принадлежит стероидным, тиреоидным
гормонам, факторам роста, инсулину, вторичным мессенджерам и т.д.
Слайд 62 Количество генов у человека 30 тысяч, в зависимости от функции они
делятся на классы:
1 – гены, кодирующие ферменты метаболизма (17% генома);
2
– гены, кодирующие белки и РНК для экспрессии генов (22%);3 – гены, кодирующие белки, которые участвуют в процессах внутриклеточной передачи сигналов (12%)
Слайд 634 – гены, кодирующие структурные белки и белки, определяющие подвижность
клетки (8%);
5 – гены, кодирующие защитные белки и белки, отвечающие
за гомеостаз (12%);6 – гены, контролирующие деление клеток и синтез ДНК (4%);
7 – гены, функция которых не известна (25%)