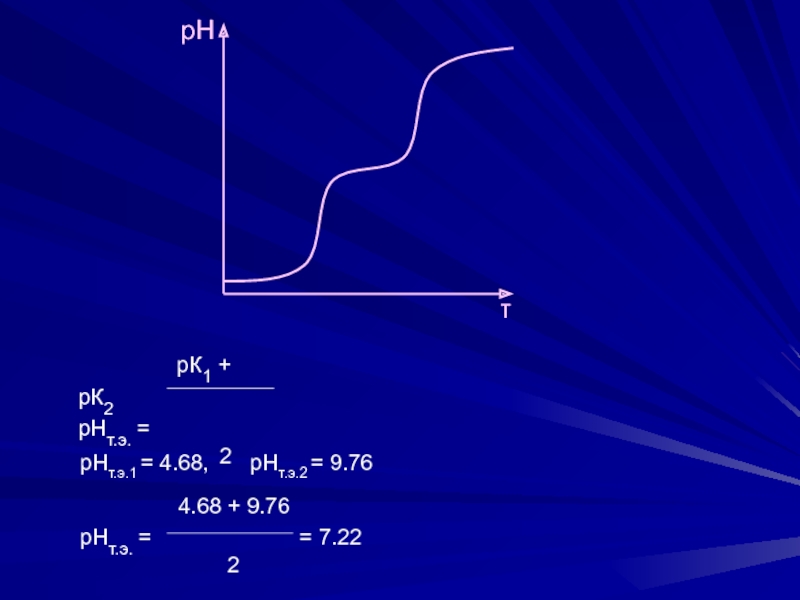
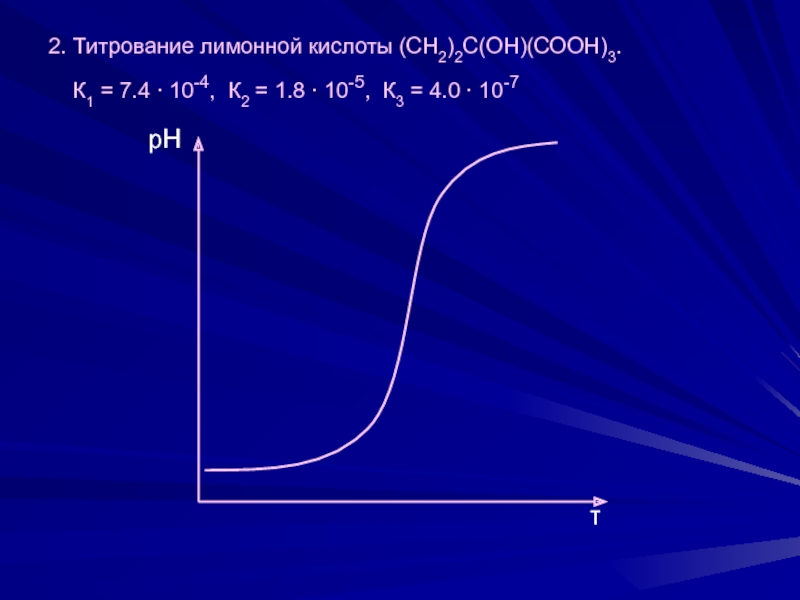
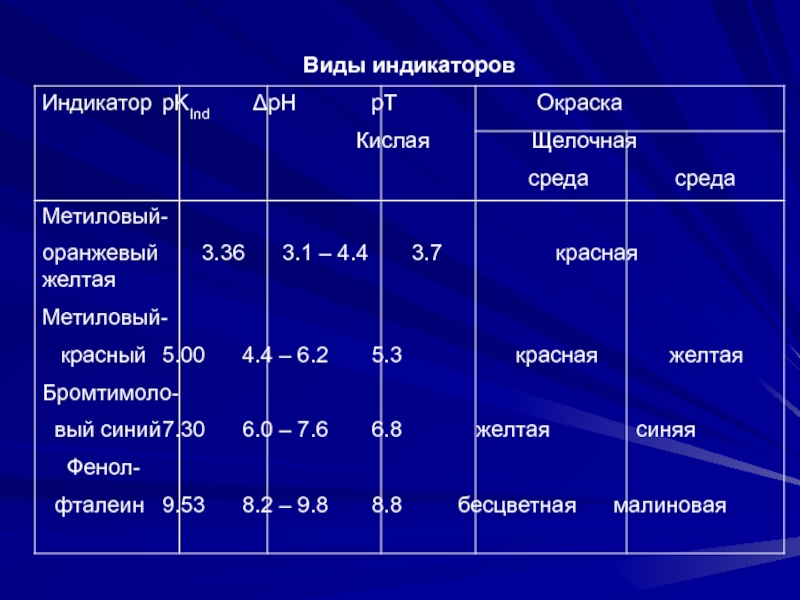
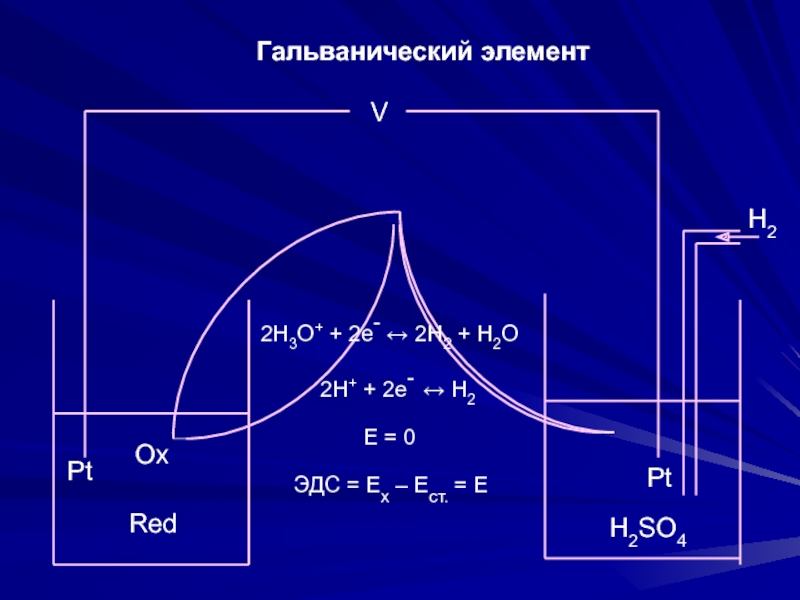
≥ 104 – возможно раздельное титрование кислот
1. Титрование фосфорной кислоты
Н3РО4К1 = 7.1 ∙ 10-3, К2 = 6.2 ∙ 10-8, К3 = 5.0 ∙ 10-13
Н3РО4 + NaOH → NaH2PO4 + H2O f = 1
NaH2PO4 + NaOH → Na2HPO4 + H2O f = 2
Na2HPO4 + NaOH → Na3PO4 + H2O f = 3
К3 = 5.0 ∙ 10-13 < 5 ∙ 10-8 – титруется как двухосновная