Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
VI группа Побочная подгруппа
Содержание
- 1. VI группа Побочная подгруппа
- 2. ХРОММОЛИБДЕНВОЛЬФРАМ
- 3. Слайд 3
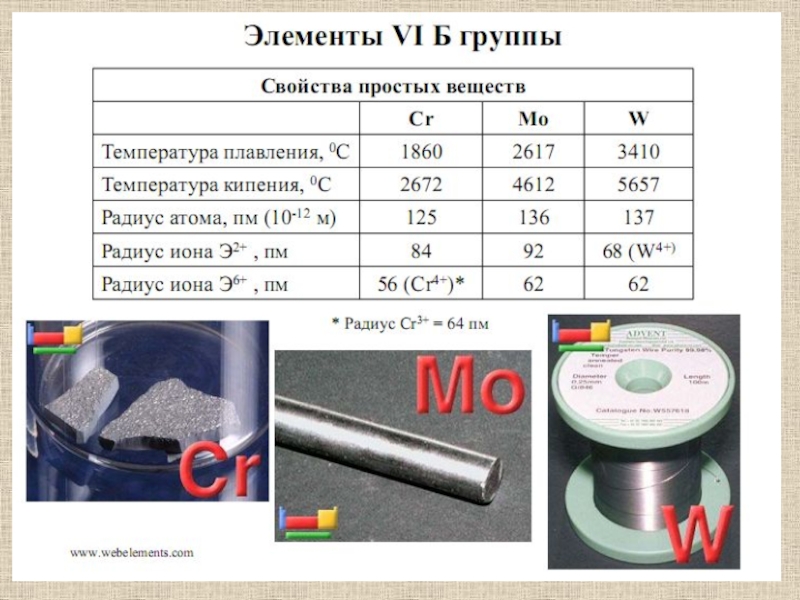
- 4. Общая электронная формула элементов ...(n-1)s2p6d5ns1, наиболее характерная
- 5. ХРОМВ 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил
- 6. Крокоит (69,06 % PbO, 30,94 % CrO3)
- 7. ПолучениеХром встречается в природе в основном в
- 8. б) растворяют хромат натрия и отделяют его
- 9. д) с помощью алюминотермии получают металлический хром:Cr2O3 + 2Al → Al2O3 +
- 10. Характерные степени окисления +2, +3, +6. Химические
- 11. Cr2O3 - аморфный порошок зеленого цвета, получается
- 12. Соединения хрома в степени окисления +3 самые
- 13. Этому ангидриду соответствуют две кислоты,H2CrO4 - хромовая,
- 14. Слайд 14
- 15. Слайд 15
- 16. Слайд 16
- 17. МОЛИБДЕН,Открыт в 1778 году шведским химиком Карлом Шееле, который прокаливая
- 18. Молибденит - MoS2
- 19. Промышленное получение молибдена начинается с обогащения руд флотационным
- 20. ВОЛЬФРАМНазвание Wolframium перешло на элемент с
- 21. Шеелит - CaWO4
- 22. Процесс получения вольфрама проходит через стадию выделения
- 23. Белые блестящие металлы, на воздухе не окисляются,
- 24. ХИМИЧЕСКИЕ СВОЙСТВАНаиболее характерная степень окисления +6. Менее
- 25. При прокаливании в кислороде металлов или их
- 26. С серой образуются сульфиды состава MeS3 в
- 27. Слайд 27
- 28. Слайд 28
- 29. Слайд 29
- 30. Слайд 30
- 31. Скачать презентанцию
ХРОММОЛИБДЕНВОЛЬФРАМ
Слайды и текст этой презентации
Слайд 4Общая электронная формула элементов ...(n-1)s2p6d5ns1, наиболее характерная степень окисления +6
Слайд 5ХРОМ
В 1766 году в окрестностях Екатеринбурга был обнаружен минерал, который получил название «сибирский красный
свинец», PbCrO4. Современное название —крокоит. В 1797 французский химик Л. Н. Воклен выделил из него
новый тугоплавкий металл).Название элемент получил от греч. χρῶμα — цвет, краска — из-за разнообразия окраски своих соединений.
Слайд 7Получение
Хром встречается в природе в основном в виде хромистого железняка
Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом (углеродом):
FeO·Cr2O3 + 4C → Fe
+ 2Cr + 4CO↑Феррохром применяют для производства легированных сталей.
Чтобы получить чистый хром, реакцию ведут следующим образом:
а) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
4Fe(CrO2)2 + 8Na2CO3 + 7O2 → 8Na2CrO4 + 2Fe2O3 + 8CO2↑
Слайд 8б) растворяют хромат натрия и отделяют его от оксида железа;
в)
переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат
2Na2CrO4 +
H2SO4 = Na2Cr2O7 + Na2SO4 + H2Oг) получают чистый оксид хрома восстановлением дихромата углём:
Na2Cr2O7 + 2C → Cr2O3 + Na2CO3 + CO↑
Слайд 9д) с помощью алюминотермии получают металлический хром:
Cr2O3 + 2Al → Al2O3 + 2Cr
Электролиз - получают электролитический хром из раствора хромового
ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:- восстановление шестивалентного хрома до трех валентного с переходом его в раствор;
- разряд ионов водорода с выделением газообразного водорода;
- разряд ионов, содержащих шестивалентный хром с осаждением металлического хрома;
Cr2O72− + 14Н+ + 12е− = 2Cr + 7H2O
Слайд 10Характерные степени окисления +2, +3, +6. Химические реакции идут при
нагревании, со всеми неметаллами, кроме азота и водорода:
2Cr + 3Cl2
= 2CrCl34Cr + 3O2 = 2Cr2O3
2Сr + 3S = Cr2S3
Растворяется в разбавленных кислотах, в концентрированных - пассивируется:
Cr + H2SO4 = CrSO4 + H2
С кислородом хром образует оксиды различного состава: CrO - оксид II хрома, твердое аморфное вещество красного цвета, получается восстановлением водородом при нагревании из оксида III хрома:
Cr2O3 + H2 = 2CrO + H2O
Соединения Cr+2 неустойчивы и окисляются на воздухе:
4Cr(OH)2 + O2 + 2H2O = 4Cr(OH)3
Слайд 11Cr2O3 - аморфный порошок зеленого цвета, получается сжиганием хрома в
кислороде, используется как катализатор, краска, входит в состав полировочных паст.
Cr2O3-амфотерный оксид, которому соответствует амфотерный гидроксид Cr(OH)3,слабое, нерастворимое в воде основание, легко растворимо в кислотах и щелочах:Cr(OH)3 + 3HCl = CrCl3 + 3H2O
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Слайд 12Соединения хрома в степени окисления +3 самые устойчивые, обладают окислительными
и восстановительными свойствами:
Cr2(SO4)3 + Zn = 2CrSO4 + ZnSO4 (ок.)
2CrCl3
+ 3KNO3 + 10KOH = 2K2CrO4 + 3KNO2 + 6KCl + 5H2O(вос.)
CrO3 - хромовый ангидрид, твердое вещество красно-бурого цвета, хорошо растворимое в воде. Получается при взаимодействии хромата калия с концентрированной серной кислотой:
K2CrO4 + H2SO4 = CrO3 + K2SO4 + H2O
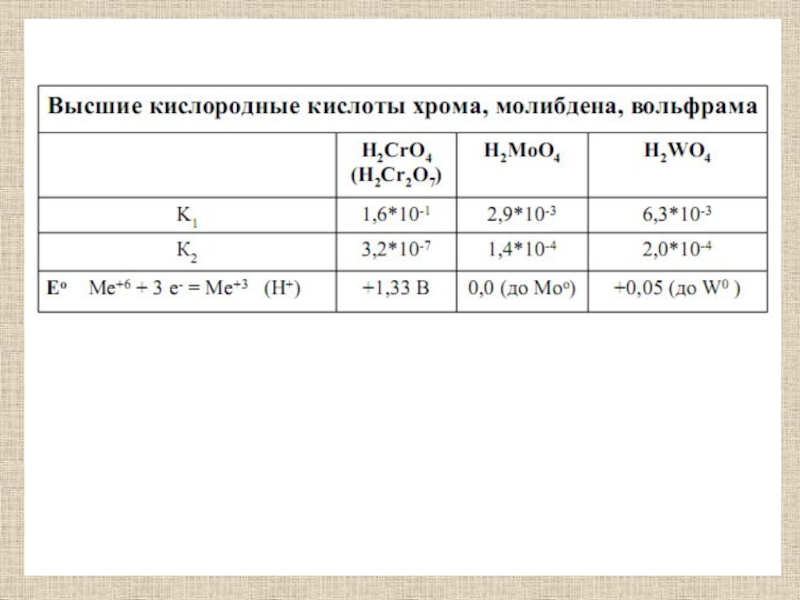
Слайд 13Этому ангидриду соответствуют две кислоты,H2CrO4 - хромовая, соли носят название
хроматы - желтого цвета и H2Cr2O7 - двуххромовая, соли бихроматы
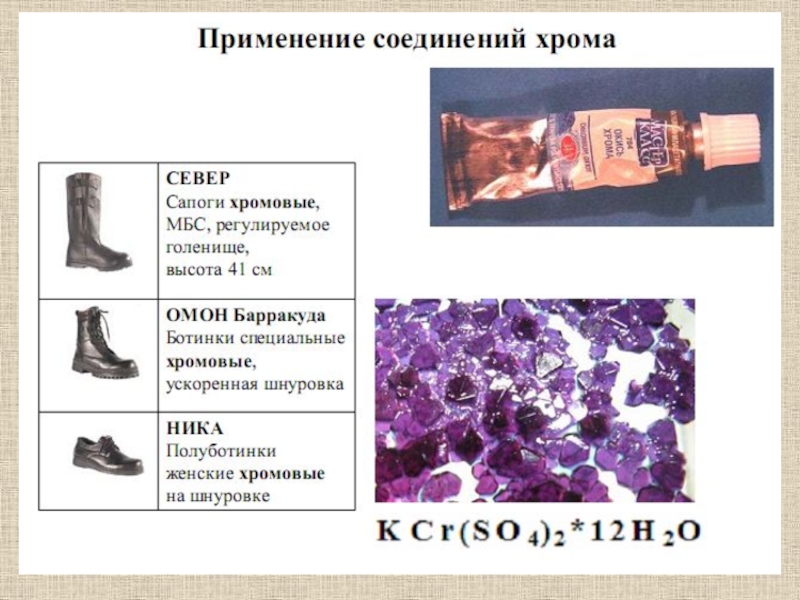
- оранжевого цвета. Хроматы и бихроматы сильнейшие окислители.Хром используется как легирующая добавка к сталям (нержавеющие), в качестве защитных покрытий на менее благородных металлах. Соединения хрома используются в качестве красок, катализаторов.
Слайд 17МОЛИБДЕН,
Открыт в 1778 году шведским химиком Карлом Шееле, который прокаливая молибденовую кислоту, получил
оксид МоО3. В металлическом состоянии впервые получен П. Гьельмом в 1782 г. восстановлением оксида углём:
он получил молибден, загрязненный углеродом и карбидом молибдена. Чистый молибден в 1817 году получил Й. Берцелиус.Название происходит от греч. μολυβδος, означающего «свинец». Оно дано из-за внешнего сходства молибденита (MoS2), минерала из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS). Вплоть до XVIII в. молибдент не отличали от графита и свинцового блеска, эти минералы носили общее название «молибден».
Слайд 19Промышленное получение молибдена начинается с обогащения руд флотационным методом. Полученный концентрат
обжигают до образования оксида МоО3:
2MoS2 + 7O2 → 2MoO3 + 4SO2
который подвергают дополнительной
очистке. Далее МоО3 восстанавливают водородом:MoO3 + 3H2= Mo + 3H2O
Полученные заготовки обрабатывают давлением (ковка, прокатка, протяжка).
Слайд 20 ВОЛЬФРАМ
Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё
в XVI в. под названием «волчья пена» — «Spuma lupi» на латыни, или
«Wolf Rahm» по-немецки. Название было связано с тем, что вольфрам, сопровождая оловянные руды, мешал выплавке олова, переводя его в пену шлаков («пожирает олово как волк овцу»).В настоящее время в США, Великобритании и Франции для вольфрама используют название «tungsten» (швед. tung sten — «тяжелый камень»).
Слайд 22Процесс получения вольфрама проходит через стадию выделения триоксида WO3 из рудных
концентратов и последующем восстановлении до металлического порошка водородом при температуре ок. 700 °C.
WO3 + 3H2=
W + 3H2OИз-за высокой температуры плавления вольфрама для получения компактной формы используются методы порошковой металлургии: полученный порошок прессуют, спекают в атмосфере водорода при температуре 1200 °C, затем пропускают через него электрический ток. Металл нагревается до 3000 °C, при этом происходит спекание в монолитный материал. Для последующей очистки и получения монокристаллической формы используется зонная плавка.
Слайд 23Белые блестящие металлы, на воздухе не окисляются, более пластичны, чем
хром. Характеризуются высокими температурами плавления (Mo - 2400oC, W -
3400oC).Вольфрам является одним из наиболее тяжелых и самым тугоплавким металлом. При температуре около 1600 °C хорошо поддается ковке и может быть вытянут в тонкую нить.
Содержание молибдена в земной коре 3·10-4% по массе. В свободном виде молибден не встречается. Известно около 20 минералов молибдена.
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трехокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов.
Слайд 24ХИМИЧЕСКИЕ СВОЙСТВА
Наиболее характерная степень окисления +6. Менее активны чем хром,
все реакции идут медленно, легко образуются при нагревании только карбиды
(WC2, MoC).В кислотах вольфрам почти нерастворим, кроме смеси азотной и плавиковой кислот. Молибден взаимодействует с концентрированной серной кислотой при нагревании:
W + 2HNO3 + 6HF = WF6 + 2NO + 4H2O
Mo + 3H2SO4 = H2MoO7 + 3SO2 + 2H2O
Слайд 25При прокаливании в кислороде металлов или их соединений образуются оксиды
MoO3 и WO3, твердые вещества, плохо растворимые в воде, но
легко растворимы в щелочах с образованием солей молибденовой и вольфрамовой кислот (H2MoO4 - белого цвета,H2WO4 - желтого цвета),твердые вещества, при нагревании отщепляющие воду и переходящие в соответствующие оксиды.При взаимодействии со фтором образуются гексафториды молибдена и вольфрама (MoF6, WF6), легко летучие жидкости, при взаимодействии с водой образуют оксосоединения типа МеOF4, MeO2F2. Гексахлорид известен только для вольфрама - темно-фиолетовое твердое вещество.
Слайд 26С серой образуются сульфиды состава MeS3 в виде порошков коричневого
или черного цвета. При нагревании на воздухе они окисляются до
MeO3, при прокаливании без кислорода отщепляют серу и переходят в сульфиды состава MeS2.В металлическом виде молибден и вольфрам применяются в металлургической промышленности при выплавке высококачественных специальных сортов стали (ружейные и орудийные стволы, броня). Вольфрам используется для производства нитей электроламп, нагревательных обмоток электропечей, антикатодов в электронных лампах, изготовления свехтвердых сплавов.