Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Второй закон термодинамики
Содержание
- 1. Второй закон термодинамики
- 2. Цели урока Образовательные:познакомить
- 3. Ответьте на вопросы 1. Вспомните формулировку
- 4. Первый закон термодинамики Первый закон
- 5. Первый закон термодинамикиЦиклически работающие тепловые машины, запрещаемые
- 6. Невозможность создания вечного двигателя
- 7. Необратимые процессы Первый закон термодинамики
- 8. Обратимые процессы Обратимыми процессами называют процессы
- 9. Обратимые процессыПроизвольный обратимый цикл как последовательность малых изотермических и адиабатических участков
- 10. Второй закон термодинамики
- 11. Второй закон термодинамики Формулировка У.Кельвина (1851 г.)Невозможно
- 12. Второй закон термодинамики Формулировка У.Кельвина (1851 г.)Гипотетическую
- 13. Второй закон термодинамики Формулировка Р. Клаузиуса (1850
- 14. Второй закон термодинамикиПроцессы, не противоречащие первому закону
- 15. Второй закон термодинамики Статистический характер
- 16. Второй закон термодинамики Статистический характер
- 17. Второй закон термодинамики Статистический характер
- 18. Второй закон термодинамики Статистический характер
- 19. Второй закон термодинамики Статистический характер
- 20. Границы применимости второго закона термодинамики
- 21. Ответьте на вопросы1. Какие процессы называются необратимыми?
- 22. Домашнее заданиеФ.10 §81
- 23. Скачать презентанцию
Цели урока Образовательные:познакомить учащихся со вторым законом термодинамики, его статистическим характером;обеспечить усвоение понятий, связанных с использованием законов термодинамики;актуализировать знания о строении вещества;расширить общий кругозор учащихся
Слайды и текст этой презентации
Слайд 1Второй закон термодинамики
Презентация разработана преподавателем КС и ПТ Каракашевой И.В.
Санкт – Петербург
2016Слайд 2Цели урока
Образовательные:
познакомить учащихся со вторым
законом термодинамики, его статистическим характером;
обеспечить усвоение понятий, связанных с использованием
законов термодинамики;актуализировать знания о строении вещества;
расширить общий кругозор учащихся
Развивающие:
создать условия для развития коммуникативных навыков;
создать условия для развития аналитических способностей учащихся, умения анализировать, сопоставлять, сравнивать , обобщать, делать выводы;
создать условия для развития памяти, внимания, воображения
Воспитательные:
способствовать развитию умения отстаивать свою точку зрения;
способствовать развитию культуры взаимоотношений при работе в коллективе
Слайд 3Ответьте на вопросы
1. Вспомните формулировку первого закона термодинамики.
2. Допускает ли первый закон термодинамики самопроизвольный переход тепла
от менее нагретого тела к более нагретому?3. Наблюдаются ли такие процессы в природе?
Слайд 4Первый закон термодинамики
Первый закон термодинамики устанавливает связь
между количеством теплоты Q, полученной системой, изменением ΔU ее внутренней энергии и работой A, совершенной над
внешними телами:Q = ΔU + A.
Согласно этому закону, энергия не может быть создана или уничтожена; она передается от одной системы к другой и превращается из одной формы в другую. Процессы, нарушающие первый закон термодинамики, никогда не наблюдались.
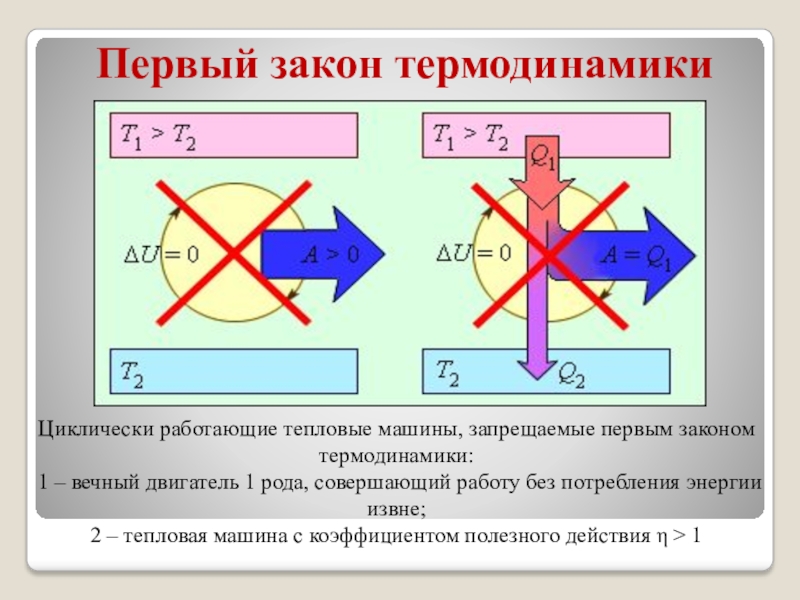
На рисунке изображены устройства, запрещенные первым законом термодинамики.
Слайд 5Первый закон термодинамики
Циклически работающие тепловые машины, запрещаемые первым законом термодинамики:
1 – вечный двигатель 1 рода, совершающий работу без потребления
энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1
Слайд 6Невозможность создания вечного двигателя
Задолго до открытия
закона сохранения энергии Французская Академия наук приняла в 1775г. решение
не рассматривать проектов вечных двигателей первого рода.Под вечным двигателем первого рода понимают устройство, которое могло бы совершать неограниченное количество работы без затраты топлива или каких-либо других материалов.
Вечные двигатели обычно конструируют на основе использования следующих приёмов или их комбинаций:
1) Подъем воды с помощью архимедова винта;
2) Подъем воды с помощью капилляров;
3) Использование колеса с неуравновешивающимися грузами;
4) Природные магниты;
5) Электромагнетизм;
6) Пар или сжатый воздух.
Слайд 7Необратимые процессы
Первый закон термодинамики не устанавливает направления
тепловых процессов.
Тепловые процессы, которые могут протекать
только в одном направлении, называются необратимыми. Например:
1. При тепловом контакте двух тел с разными температурами тепловой поток всегда направлен от более теплого тела к более холодному. Никогда не наблюдается самопроизвольный процесс передачи тепла от тела с низкой температурой к телу с более высокой температурой, т.е. процесс теплообмена при конечной разности температур является необратимым.
2. Процесс диффузии. Открыв пузырёк с духами, мы быстро почувствуем запах духов. Молекулы ароматического вещества благодаря тепловому движению проникают в пространство между молекулами воздуха. Трудно представить, чтобы все они вновь собрались в пузырьке.
Все реальные процессы необратимы
Слайд 8Обратимые процессы
Обратимыми процессами называют процессы перехода системы из
одного равновесного состояния в другое, которые можно провести в обратном
направлении через ту же последовательность промежуточных равновесных состояний. При этом сама система и окружающие тела возвращаются к исходному состоянию.Равновесное состояние — это состояние, при котором температура и давление во всех точках системы одинаковы.
Обратимый процесс должен протекать очень медленно, чтобы каждое промежуточное состояние было равновесным.
Круговой процесс, состоящий из двух изотерм и двух адиабат (цикл Карно) является единственным обратимым круговым процессом, при котором рабочее тело приводится в тепловой контакт только с двумя тепловыми резервуарами. Все остальные круговые процессы, проводимые с двумя тепловыми резервуарами, необратимы.
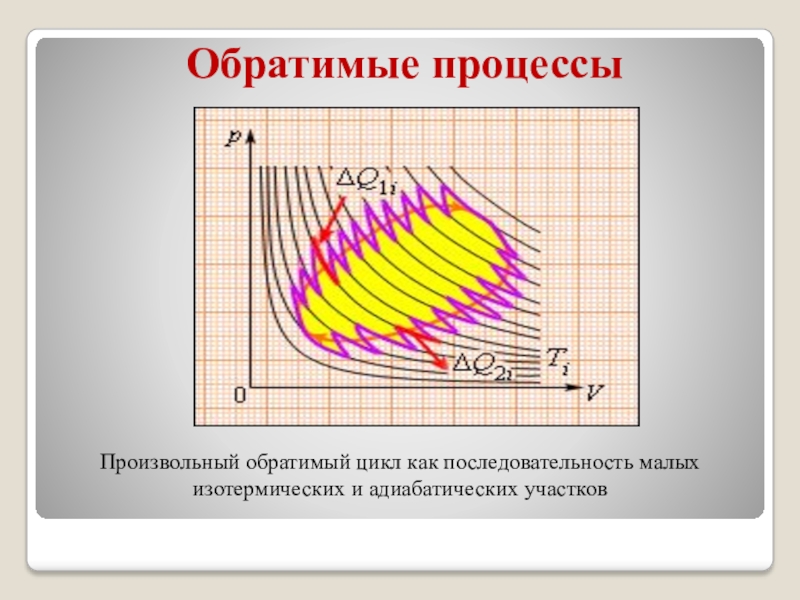
Слайд 9Обратимые процессы
Произвольный обратимый цикл как последовательность малых изотермических и адиабатических
участков
Слайд 10Второй закон термодинамики
Первый закон термодинамики
не может отличить обратимые процессы от необратимых. Он просто требует
от термодинамического процесса определенного энергетического баланса и ничего не говорит о том, возможен такой процесс или нет.Направление самопроизвольно протекающих процессов устанавливает второй закон термодинамики. Он может быть сформулирован в виде запрета на определенные виды термодинамических процессов.
Слайд 11Второй закон термодинамики
Формулировка У.Кельвина (1851 г.)
Невозможно осуществить такой периодический процесс,
единственным результатом которого было бы совершение работы за счет теплоты
взятой от одного источникаСлайд 12Второй закон термодинамики
Формулировка У.Кельвина (1851 г.)
Гипотетическую тепловую машину, в которой
мог бы происходить такой процесс, называют вечным двигателем второго рода.
В
земных условиях такая машина могла бы отбирать тепловую энергию, например, у Мирового океана и полностью превращать ее в работу. Масса воды в Мировом океане составляет примерно 1021 кг, и при ее охлаждении на один градус выделилось бы огромное количество энергии (≈ 1024 Дж), эквивалентное полному сжиганию 1017 кг угля. Ежегодно вырабатываемая на Земле энергия приблизительно в 104 раз меньше. Поэтому вечный двигатель второго рода был бы для человечества не менее привлекателен, чем вечный двигатель первого рода, запрещенный первым законом термодинамики.
Слайд 13Второй закон термодинамики
Формулировка Р. Клаузиуса (1850 г.)
Невозможен процесс, единственным результатом
которого была бы передача энергии путем теплообмена от тела с
низкой температурой к телу с более высокой температурой.Слайд 14Второй закон термодинамики
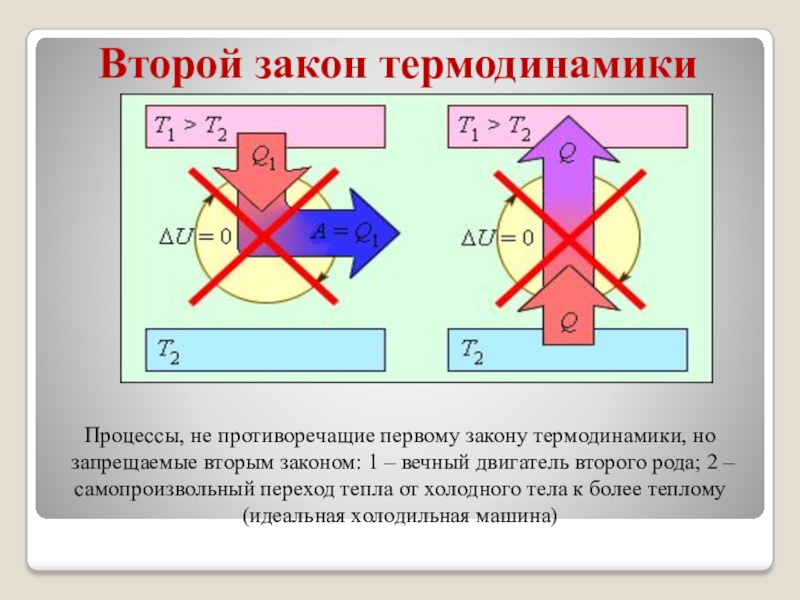
Процессы, не противоречащие первому закону термодинамики, но запрещаемые
вторым законом: 1 – вечный двигатель второго рода; 2 –
самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина)Слайд 15Второй закон термодинамики
Статистический характер
Констатируя факт необратимости
процессов в природе, второй закон не дает ему никакого объяснения.
Необратимость макропроцессов вроде парадоксальна: ведь все микропроцессы обратимы.В микромире нет сил трения; все силы – электромагнитные, зависят только от взаимного положения частиц и поэтому обратимы во времени. Уравнения движения молекулы тоже обратимы во времени, т.к. содержат только силы, зависящие от расстояний.
Одному и тому же макросостоянию системы отвечает огромное число микроскопических состояний.
Переход одной молекулы на место другой – уже изменение микросостояния системы, но это не приводит к изменению макросостояния
Слайд 16Второй закон термодинамики
Статистический характер
Стрела времени
Во всех процессах
существует выделенное направление, в котором процессы происходят сами собой
В процессах,
протекающих произвольно, более упорядоченные состояния заменяются на менее упорядоченныеЧем больше «порядок» в системе, тем труднее восстановить его из «беспорядка»
Выделенное направление времени, воспринимаемое человеком, связано с направленностью процессов в мире.
Л. Больцманн
Слайд 17Второй закон термодинамики
Статистический характер
Л.Больцман высказал предположение, что
все микросостояния замкнутой системы равновероятны.
Микросостояния непрерывно сменяют
друг друга, а макросостояние остается неизменным.Чем больше микросостояний реализуют данное макросостояние, тем оно более вероятно.
Т.о., эволюция системы происходит в направлении от маловероятных состояний к состояниям более вероятным.
Обратный процесс не является невозможным, просто он чрезвычайно маловероятен.
Слайд 18Второй закон термодинамики
Статистический характер
Так, состояние газа,
при котором молекулы движутся хаотично, является наиболее вероятным, наиболее вероятным
является и равномерное распределение молекул по объёмуОднако возможно, что благодаря случайным перемещениям молекул все они окажутся в какой-то части сосуда, но вероятность такого состояния чрезвычайно мала.
Соответственно не противоречит законам природы даже такой процесс, в результате которого при случайном движении молекул воздуха все они соберутся в одной половине класса, а учащиеся в другой половине класса задохнутся.
Но реально это событие никогда не происходило в прошлом и не произойдёт в будущем.
Слайд 19Второй закон термодинамики
Статистический характер
Слишком мала
вероятность подобного события, чтобы оно когда-либо случилось за всё время
существования Вселенной в современном её состоянии — около нескольких миллиардов лет.По приблизительным оценкам, эта вероятность примерно такого же порядка, как и вероятность того, что
20 000 обезьян, хаотично ударяя по клавишам пишущих машинок, напечатают без единой ошибки «Войну и мир» Л. Н. Толстого. В принципе это возможно, но реально никогда не произойдёт.
Слайд 20Границы применимости второго закона термодинамики
Закон справедлив
только для систем с огромным числом частиц ( в системах
с малым числом частиц могут наблюдаться случайные отклонения от равновесного состояния)Такие случайные отклонения системы от равновесия называются флуктуациями.
Именно флуктуациями плотности газа в областях порядка длины световой волны объясняются рассеяние света в атмосфере Земли и голубой цвет неба. Флуктуации давления в малых объёмах объясняют броуновское движение.