Слайд 1Использование ИКТ на уроках химии
Учитель Михайлова Людмила Федоровна.
Слайд 2В своей педагогической деятельности использую технологию развивающего обучения, направленную на
обеспечение личности гимназиста. При данной технологии можно использовать проблемные уроки,
уроки исследования, практический эксперемент и другие методы. Что бы уроки были более наглядными и современными использую мультимедийные комплекты ( «Общая химия» и «Органическая химия») и презентации уроков .
На пример в 8 классе при изучении темы «Вещества» учащиеся выполняют лабораторный опыт « Изучение свойств алюминия»,что бы лучше понять где применяются в народном хозяйстве свойства алюминия и почему рассматриваем фрагмент презентации.
Слайд 4Использую компьютер для проверки и закрепления некоторых тем: «Типы химических
связей», «Классы неорганических веществ» и др.
Использую фрагмент презентаций на пример.
Слайд 6Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2,
BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO, PH3, HBr, NaBr, N2,
K2O, P4, H2S.
Слайд 7Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2,
BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO, PH3, HBr, NaBr, N2,
K2O, P4, H2S.
Слайд 8Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2,
BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO, PH3, HBr, NaBr, N2,
K2O, P4, H2S.
Слайд 9Из нижеприведённых формул веществ выпишите формулы в данные столбцы: F2,
BaI2, H2O, FeCI3,CaF2, Li3N, O2, CO, PH3, HBr, NaBr, N2,
K2O, P4, H2S.
Слайд 11Задачи урока.
Систематизировать и углубить знания учащихся о законе сохранения
энергии и превращениях её при химических реакциях
Повторить и расширить знания
учащихся о тепловом эффекте реакции, термохимическом уравнении
Познакомить с законом Г. И. Гесса, с понятием «теплота образования соединения», «энтропия».
Закрепить умения решать расчетные задачи по термохимии, научить решать задачи с использованием закона Г. И. Гесса.
Слайд 12План урока
Закон сохранения энергии в химических реакциях. Экзо- и эндотермические
реакции.
Тепловой эффект реакции. Термохимические уравнения реакций.
Закон Г. И. Гесса.
Применение
закона Г. И. Гесса. Решение задач.
Понятие «энтальпии»
Слайд 13Какой общий признак объединяет следующие реакции:
Горение спирта
Взрыв тротила
Нейтрализация кислоты
щелочью
Взаимодействие натрия с водой
Гашение негашеной извести водой
Процесс фотосинтеза
Разложение известняка
Крекинг углеводородов
Гидролиз
крахмала
Превращение кислорода в озон
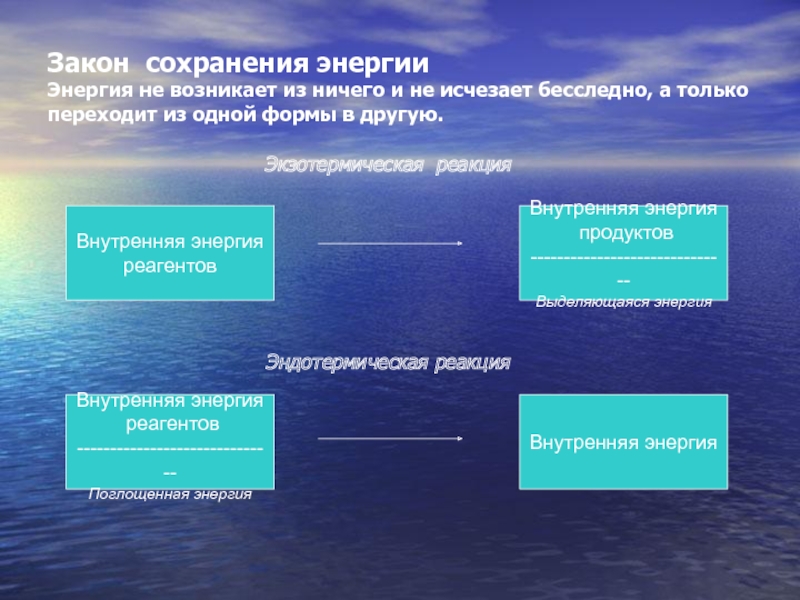
Слайд 14Закон сохранения энергии
Энергия не возникает из ничего и не исчезает
бесследно, а только переходит из одной формы в другую.
Экзотермическая реакция
Эндотермическая
реакция
Внутренняя энергия
реагентов
Внутренняя энергия
продуктов
------------------------------
Выделяющаяся энергия
Внутренняя энергия
Внутренняя энергия
реагентов
------------------------------
Поглощенная энергия
Слайд 15Тепловой эффект реакции.
Термохимические уравнения .
Как подсчитать тепловой эффект реакции?
H2 +
CI2 2HCI
EH-H=436 кДж, ЕH-CI=430 кДж, ECI-CI=
240 кДж.
Qp = ΣQпродуктов – ΣQреагентов
Qp = 2 * 430 – (436 + 240) = 860 – 676 = 184 кДж
H2 + CI2 = 2HCI + 184 кДж
Слайд 16Теплота образования соединения (Qобр)-это тепловой эффект реакции образования одного моля
соединения из простых веществ, устойчивых в стандартных условиях (25о С,1атм)
С
+ О2= СО2 +394кДж
0,5 N2 + 0,5 O2 = NO – 90кДж
Слайд 17Закон Г. И. Гесса
Тепловой эффект химической реакции не зависит от
промежуточных стадий ( при условии, что исходные вещества и продукты
одинаковы).
С + О2 СО2 + 394кДж моль (Q1)
C + 0,5O2 CO + Q2
CO + 0,5O2 CO2 + 284кДж моль(Q3)
Q1 = Q2 + Q3, отсюда Q2 = Q1 – Q3= 394 – 284 = 110
Qp = Σ Qобр(продуктов) - Σ Qобр(реагентов)
Слайд 18задача
Исходя из следующих данных :
CH4= C(графит) + 2H2 – 74,9
кДж,
C (графит) + O2 = CO2 + 393.5 kДж,
2H2 +
O2 = 2H2O + 571.6 кДж;
Вычислите тепловой эффект химической реакции
CH4 + 2O2 CO2 + 2H2O + Q.
Слайд 19Решение задачи
Суммируем левые и правые части химических уравнений реакций
CH4+ C
+ O2 +2H2 + O2 = 2H2 + C +
CO2 + 2H2O + ( -74,9 +393,5 + 571,6)
CH4 + 2O2 = CO2 + 2H2O + 890,2 кДж