Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
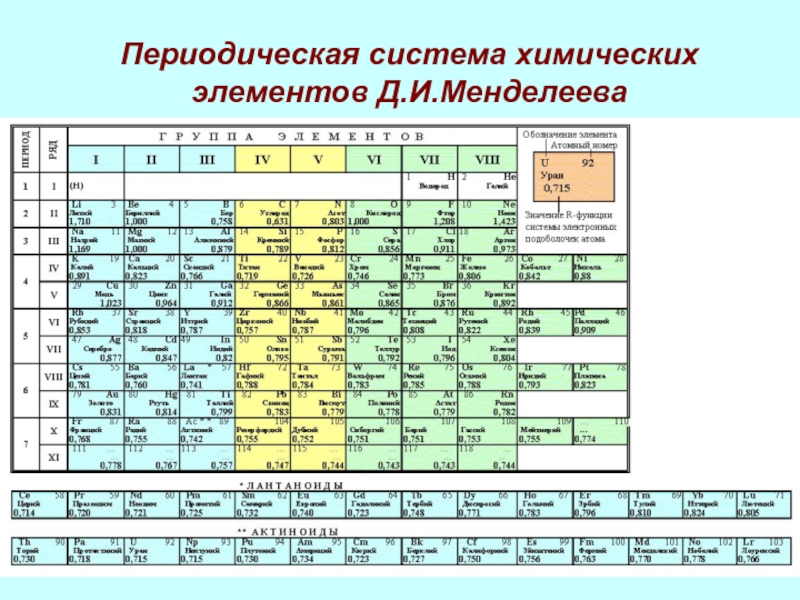
Периодическая система химических элементов Д.И.Менделеева
Содержание
- 1. Периодическая система химических элементов Д.И.Менделеева
- 2. Другого ничего в природе нетНи здесь, ни
- 3. Периодическая система химических элементов Д.И.Менделеева
- 4. Мы шагаем по Периодической… Характеристика химического
- 5. Цели урока:Изучить план характеристики химического элемента и
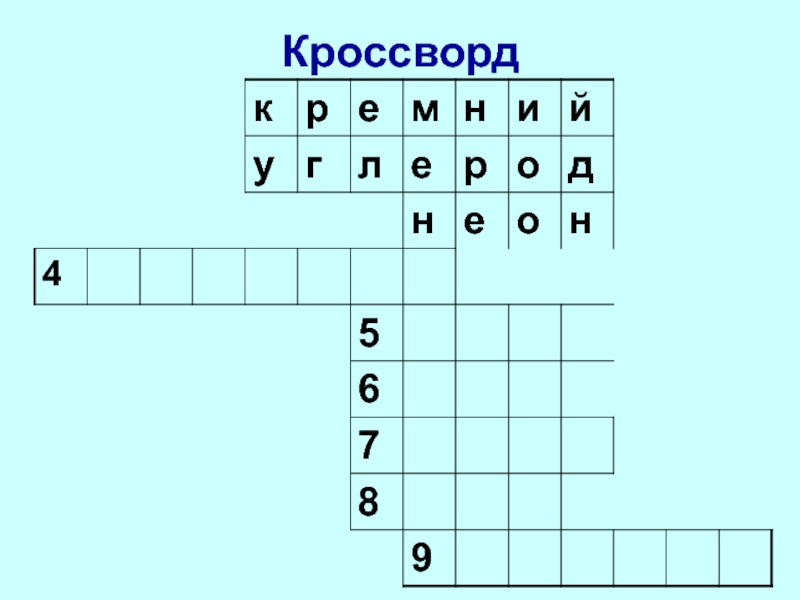
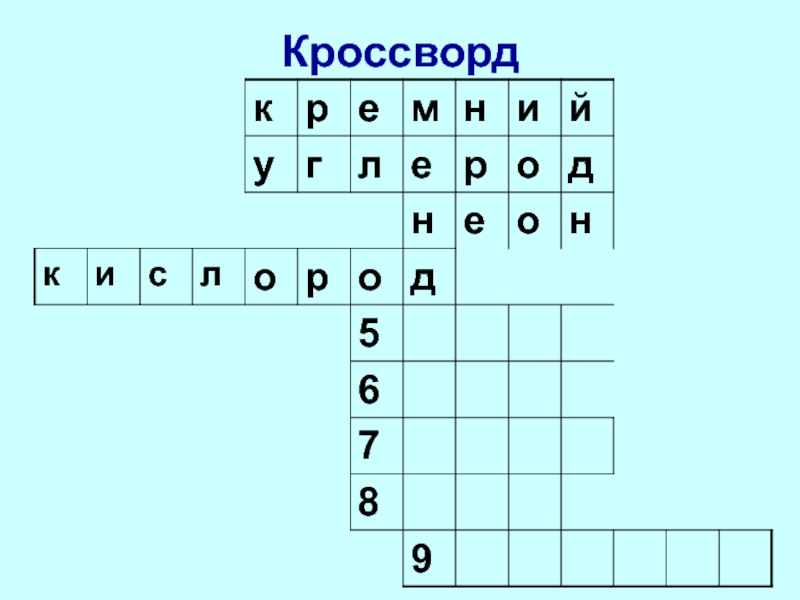
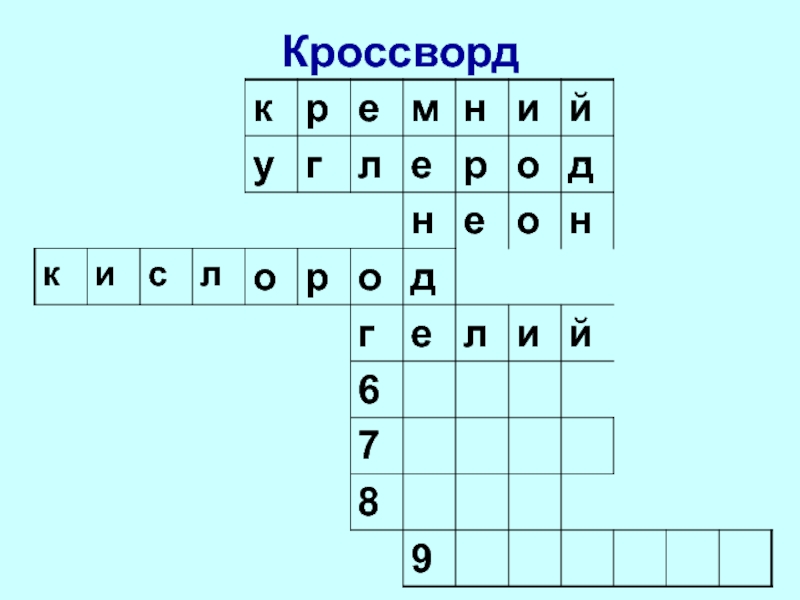
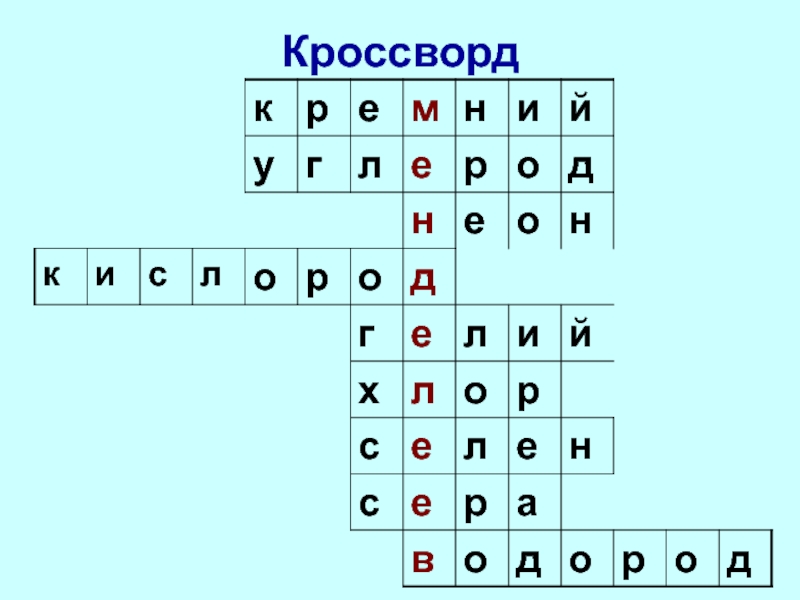
- 6. Кроссворд
- 7. Кроссворд
- 8. Кроссворд
- 9. Кроссворд
- 10. Кроссворд
- 11. Кроссворд
- 12. Кроссворд
- 13. Кроссворд
- 14. Кроссворд
- 15. Кроссворд
- 16. Кроссворд
- 17. Д.И.Менделеев (1834-1907)-великий русский учёный. Открыл
- 18. Пусть имя Д.И. Менделеева будет нашей путеводной звездой
- 19. Периодическая система и строение атомаПериодическая система- это….Физический смысл номера:элементапериодагруппыПричины изменения свойств элементов: периоде, в группе
- 20. ЗакономерностиВ периодах слева направо число электронов на
- 21. План характеристики элемента.1. Положение элемента в ПС
- 22. Первая остановка - государство металловЧтобы узнать какой элемент нас встречает, откроем черный ящикХарактеристика элемента по плануплан
- 23. План характеристики элемента.1. Положение элемента в ПС
- 24. Характеристика металла натрия1.Натрий (Na)- элемент 3 периода,
- 25. ФизкультминуткаГимнастика для глаз
- 26. Вторая остановка- государство неметаллов 1.Задача. Элемент
- 27. План характеристики элемента.1. Положение элемента в ПС
- 28. Слайд 28
- 29. Характеристика неметалла серыСера(S)- элемент 3 периода, 6
- 30. Лабораторная работа В трех пробирках даны вещества:
- 31. Третья остановка- государство переходных элементовПисьмо: В тринадцатой
- 32. Слайд 32
- 33. План характеристики элемента.1. Положение элемента в ПС
- 34. Характеристика алюминияАлюминий ( Al)- элемент 3 периода,
- 35. Выводы :Химические элементы делятся на…….Атомы металлов на
- 36. 6.Атомы неметаллов на внешнем уровне содержат…… электронов.
- 37. Проанализируйте стихотворение Гладкова с т.з. химии
- 38. Человек рождается на свет, Чтоб творить, дерзать-
- 39. Я узнал …Я запомнил …Полученные на уроке знания мне пригодятся…….Мне понравилось …Выскажите свое мнение об уроке
- 40. Домашнее заданиеХарактеристика элемента по плану с порядковыми номерами: 7, 12.
- 41. Спасибо за сотрудничество. До свидания!
- 42. Скачать презентанцию
Другого ничего в природе нетНи здесь, ни там, в космических глубинах:Все - от песчинок малых до планет-Из элементов состоит единых.
Слайды и текст этой презентации
Слайд 4Мы шагаем по Периодической…
Характеристика химического элемента по его
положению в периодической системе химических элементов
Д.И. Менделеева
Слайд 5Цели урока:
Изучить план характеристики химического элемента и научиться применять его
на практике.
Обобщить и закрепить знания учащихся об основных закономерностях в
изменении свойств элементов и их соединений, отраженных в периодической системе.Продолжить формирование умения работать с таблицей химических элементов.
Слайд 17
Д.И.Менделеев (1834-1907)-великий русский учёный. Открыл периодический закон химических
элементов. Автор классического труда «Основы химии», фундаментальных исследований по химии,
физике, метрологии. Предложил промышленный способ фракционного разделения нефти, изобрёл вид бездымного пороха.Слайд 19Периодическая система и строение атома
Периодическая система- это….
Физический смысл номера:
элемента
периода
группы
Причины изменения
свойств элементов:
периоде, в группе
Слайд 20Закономерности
В периодах слева направо число электронов на внешнем электронном слое
….., число электронных слоёв ….. , радиус атомов …... Следовательно,
металлические свойства….., а неметаллические….В группах сверху вниз число электронных слоёв ….., число электронов на внешнем слое ……, радиус атомов ……... Следовательно, неметаллические свойства….., а металлические……
Слайд 21План характеристики элемента.
1. Положение элемента в ПС (номер, период, группа,
подгруппа).
2.Строение атома . Степени окисления.
3.Электронная формула, семейство элемента.
4.Характер элемента (металл,
неметалл, переходный) и простого вещества.5.Состав высшего оксида, его характер.
6.Состав гидрата оксида, его характер.
7.Состав летучего водородного соединения (для неметаллов).
8. Генетический ряд.
Слайд 22Первая остановка - государство металлов
Чтобы узнать какой элемент нас встречает,
откроем черный ящик
Характеристика элемента по плану
план
Слайд 23План характеристики элемента.
1. Положение элемента в ПС (номер, период, группа,
подгруппа).
2.Строение атома . Степени окисления.
3.Электронная формула, семейство элемента.
4.Характер элемента (металл,
неметалл, переходный) и простого вещества.5.Состав высшего оксида, его характер.
6.Состав гидрата оксида, его характер.
7.Состав летучего водородного соединения (для неметаллов).
8. Генетический ряд.
Слайд 24Характеристика металла натрия
1.Натрий (Na)- элемент 3 периода, 1группы, главной подгруппы,
порядковый номер -11, относительная атомная масса – 23.
2. Строение атома:
заряд ядра= +11, протонов= 11, нейтронов = 12, электронов = 11. Распределение электронов по энергетическим уровням: 2, 8, 1. Степень окисления = +13.Электронная формула: 1S22S22P63S1, s- элемент.
4.Простое вещество- щелочной металл, имеет металлическую связь и металлическую кристаллическую решетку.
5.Высший оксид Na2O - основной.
6.Гидрат оксида NaOH - щелочь
7. Летучее водородное соединение не образует
8. Генетический ряд: Na→Na2O→NaOH→NaCl
опыт
Слайд 26Вторая остановка- государство неметаллов
1.Задача.
Элемент образует высший оксид
состава ЭО3. С водородом этот элемент образует летучее соединение, массовая
доля водорода в котором составляет 5,88%. Рассчитайте относительную атомную массу элемента и назовите его2. Характеристика элемента по плану
Слайд 27План характеристики элемента.
1. Положение элемента в ПС (номер, период, группа,
подгруппа).
2.Строение атома . Степени окисления.
3.Электронная формула, семейство элемента.
4.Характер элемента (металл,
неметалл, переходный) и простого вещества.5.Состав высшего оксида, его характер.
6.Состав гидрата оксида, его характер.
7.Состав летучего водородного соединения (для неметаллов).
8. Генетический ряд.
Слайд 29Характеристика неметалла серы
Сера(S)- элемент 3 периода, 6 А группы, порядковый
номер -16, относительная атомная масса 32.
Строение атома: заряд ядра =+16,
протонов = 16, нейтронов = 16, электронов = 16. Распределение электронов по энергетическим уровням: 2, 8, 6. Высшая степень окисления = +6, низшая степень окисления = -2.Электронная формула: 1S22S22P63S23р4 , р-элемент
Простое вещество- неметалл, имеет молекулярную кристаллическую решетку.
Высший оксид SО3 – кислотный.
Гидрат оксида Н2SО4– серная кислота.
Летучее водородное соединение Н2S –сероводород
Генетический ряд: S→ SО3→ Н2SО4→ВаSО4
Опыт 1
Опыт2
Слайд 30Лабораторная работа
В трех пробирках даны вещества:
Соляная кислота,
серная
кислота,
гидроксид натрия.
Определите каждое из веществ.
Объясните результаты опыта.
Слайд 31Третья остановка- государство переходных элементов
Письмо: В тринадцатой квартире живу,
известный в мире как проводник прекрасный, пластичен, серебрист. Еще по
части сплавов завоевал я славу и в этом деле, я специалист. По внешности, я видный, хоть пленкою оксидной покрыт, она мне- прочная броня. Я мягкий, ковкий, сверкаю в упаковке. Обернуты конфеты блестящею фольгой .Для плиток шоколада меня немало надо, а раньше был я очень дорогой.
О каком элементе и простом веществе идет речь?
Дайте характеристику элементу по плану
Слайд 33План характеристики элемента.
1. Положение элемента в ПС (номер, период, группа,
подгруппа).
2.Строение атома . Степени окисления.
3.Электронная формула, семейство элемента.
4.Характер элемента (металл,
неметалл, переходный) и простого вещества.5.Состав высшего оксида, его характер.
6.Состав гидрата оксида, его характер.
7.Состав летучего водородного соединения (для неметаллов).
8. Генетический ряд.
Слайд 34Характеристика алюминия
Алюминий ( Al)- элемент 3 периода, 3А группы, порядковый
номер -13, относительная атомная масса равна 27
Строение атома: заряд ядра
= +13, протонов = 13, нейтронов =14, электронов =13, распределение электронов по энергетическим уровням: 2,8,3. Степень окисления =+3Элемент- переходный, простое вещество – металл, имеет металлическую кристаллическую решетку.
Электронная формула: 1S22S22P63S23р1 , р-элемент
Высший оксид Al2O3 - амфотерный.
Гидрат оксида Al(OH)3 - амфотерное основание
Летучее водородное соединение не образует
Генетический ряд: Al→ Al2O3→AlCl3→ Al(OH)3
Опыт 3
Слайд 35Выводы :
Химические элементы делятся на…….
Атомы металлов на внешнем уровне содержат……электронов.
При химических реакциях металлы способны……электроны, т.е.проявляют …….. свойства
Простое вещество металл
имеет ……..кристаллическую решетку и ……..химическую связь.4. Металлу соответствует…….оксид, которому соответствует ……
5. Основные оксиды и основания имеют общее свойство: реагируют с…… и ……….
Слайд 36
6.Атомы неметаллов на внешнем уровне содержат…… электронов. Атомы неметаллов могут
присоединять и отдавать электроны, т.е. проявляют ……… и ………. свойства
7.Неметаллу
соответствует……. оксид, которому соответствует……..8.Кислотные оксиды и кислоты имеют общее свойство: реагируют с …… и ……..
9.Оксиды и гидроксиды переходных элементов проявляют……..свойства, т.е. реагируют и с …… и с…….
Слайд 37Проанализируйте стихотворение Гладкова с т.з. химии
Пусть зимний день
с метелями
Не навевает грусть-
Таблицу Менделеева я
знаю наизусть.Зачем ее я выучил? Могу сказать, зачем:
В ней стройность и величие
любимейших поэм,
Без многословья книжного
в ней смысла торжество,
И элемента лишнего в ней нет ни одного;
В ней пробужденье дерева и внешних льдинок хруст.
Таблицу Менделеева я знаю наизусть!
Слайд 38
Человек рождается на свет,
Чтоб творить, дерзать- и не иначе,
Чтоб
оставить в жизни добрый след
И решить все трудные задачи.
Человек рождается
на свет….Для чего? Ищите свой ответ.