Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Презентация по теме "Оксиды"
Содержание
- 1. Презентация по теме "Оксиды"
- 2. Содержание 1). Определение 2). Классификация оксидов 3).
- 3. ОпределениеОксиды – это сложные вещества, которые состоят
- 4. Классификация
- 5. Слайд 5
- 6. Слайд 6
- 7. Физические свойства Оксиды бывают твёрдые, жидкие
- 8. Химические свойства оксидов
- 9. Видео Взаимодействие основных оксидов с кислотами
- 10. Видео Взаимодействие кислотных оксидов с водой
- 11. ПрименениеН2О – оксид водорода (вода) – в
- 12. Вопросы для повторения1). Оксиды – это сложные
- 13. Скачать презентанцию
Содержание 1). Определение 2). Классификация оксидов 3). Получение оксидов 4). Физические свойства 5). Химические свойства 6). Применение 7). Вопросы для повторения
Слайды и текст этой презентации
Слайд 2Содержание
1). Определение
2). Классификация оксидов
3). Получение оксидов
4).
Физические свойства
повторенияСлайд 3Определение
Оксиды – это сложные вещества, которые состоят из двух элементов,
одним из которых является кислород.
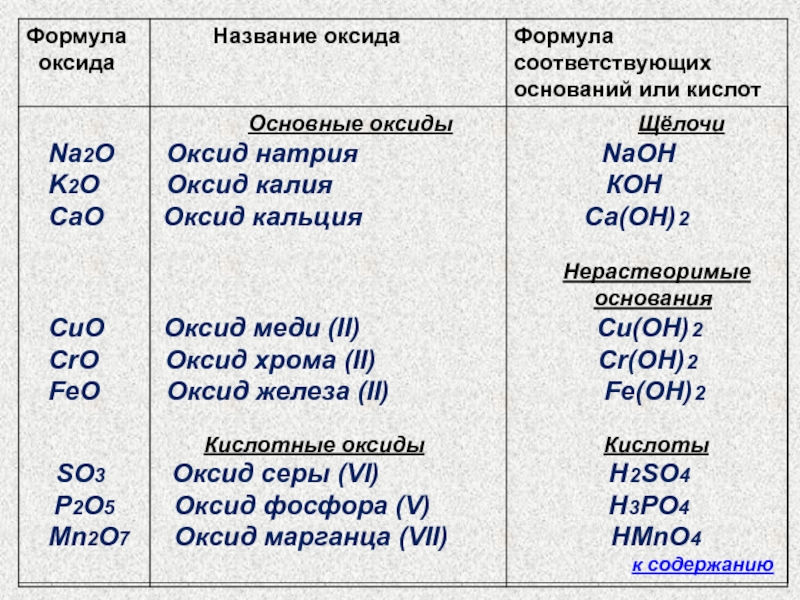
Названия оксидов, в состав
которых входят химические элементы с постоянной валентностью, даются без упоминания о валентности. Например: MgO – оксид магния.Если же они образованы химическими элементами с переменной валентностью, то рядом с названием оксида ставится в скобках валентность. Например: SO2 – оксид серы (IV), SO3 – оксид серы (VI).
к содержанию
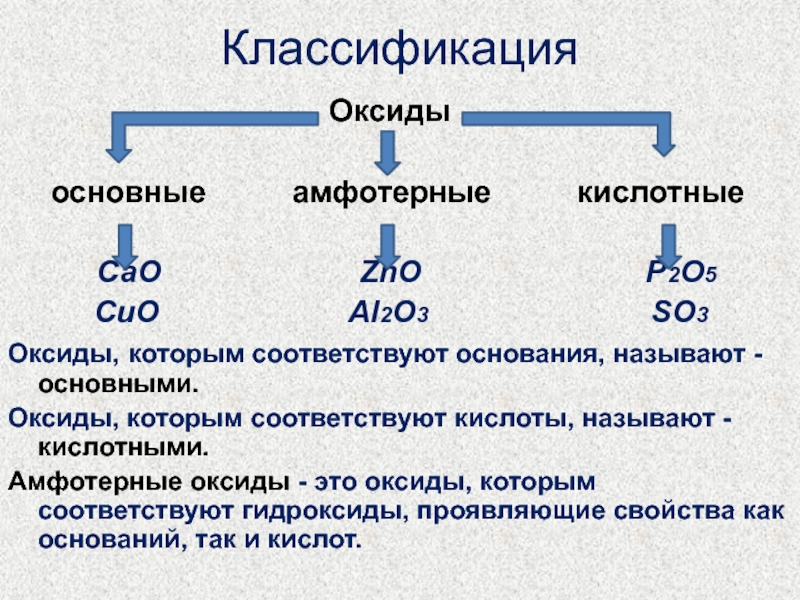
Слайд 4Классификация
Оксиды
основные амфотерные кислотные
СаО ZnO P2O5
CuO Al2O3 SO3
Оксиды, которым соответствуют основания, называют - основными.
Оксиды, которым соответствуют кислоты, называют - кислотными.
Амфотерные оксиды - это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот.
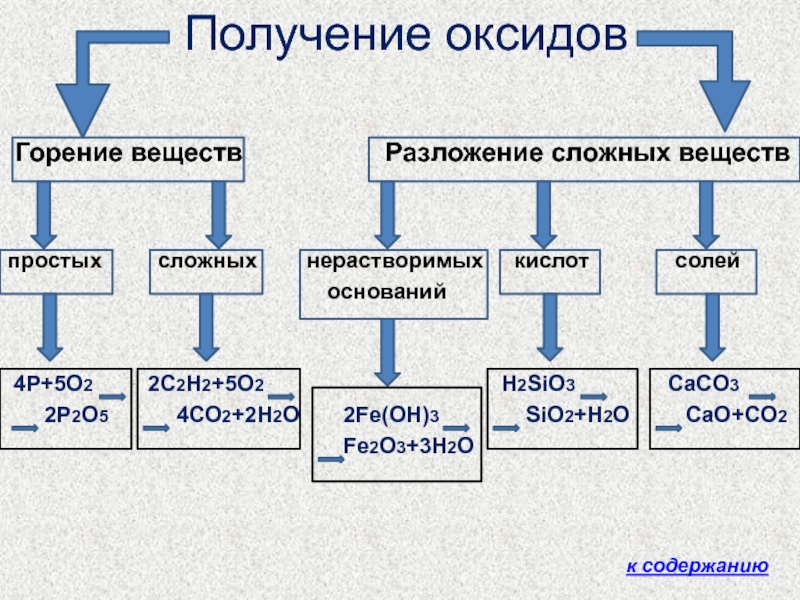
Слайд 6 Получение оксидов
Горение
веществ
Разложение сложных веществпростых сложных нерастворимых кислот солей
оснований
4Р+5О2 2С2Н2+5О2 H2SiO3 CaCO3
2Р2О5 4СО2+2Н2О 2Fe(OH)3 SiO2+H2O CaO+CO2
Fe2O3+3H2O
к содержанию
Слайд 7Физические свойства
Оксиды бывают твёрдые, жидкие и газообразные, различного
цвета.
твёрдые
жидкие газообразныеСuO - оксид меди (II) Н2О - оксид водорода СО2 - оксид
чёрного цвета (вода) бесцветная углерода (IV)
бесцветный газ
СаО - оксид кальция
белого цвета NO2 – оксид
азота (IV)
бурого цвета
к содержанию
Слайд 11Применение
Н2О – оксид водорода (вода) – в промышленности и в
быту.
SiO2 – оксид кремния (IV) – в производстве строительных материалов.
СаО
– оксид кальция – для получения гашёной извести Са(ОН)2Из руд, состоящих из оксидов железа Fe2O3 и Fe3O4 получают чугун и сталь.
ZnO – оксид цинка – основная часть белой краски – цинковых белил.
к содержанию
Слайд 12Вопросы для повторения
1). Оксиды – это сложные вещества, которые состоят
из элементов, одним из которых является
2). Что обозначает римская цифра в скобках после названия оксида -
3). При горении простых и сложных веществ образуются –
4). Дайте название формуле CuO (II) –
5). Формула оксида алюминия –
6). Каким оксидом является СаО –
7). Каким оксидом является СО2 по физическим свойствам - к содержанию
двух
кислород
валентность элемента
оксиды
оксид меди (II)
Al2O3
основным
газообразным