Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Липиды
Содержание
- 1. Липиды
- 2. Слайд 2
- 3. · Нерастворимость в воде· Растворимость в органических
- 4. Слайд 4
- 5. Терморегуляторная функция – а)жир плохо проводит тепло
- 6. Слайд 6
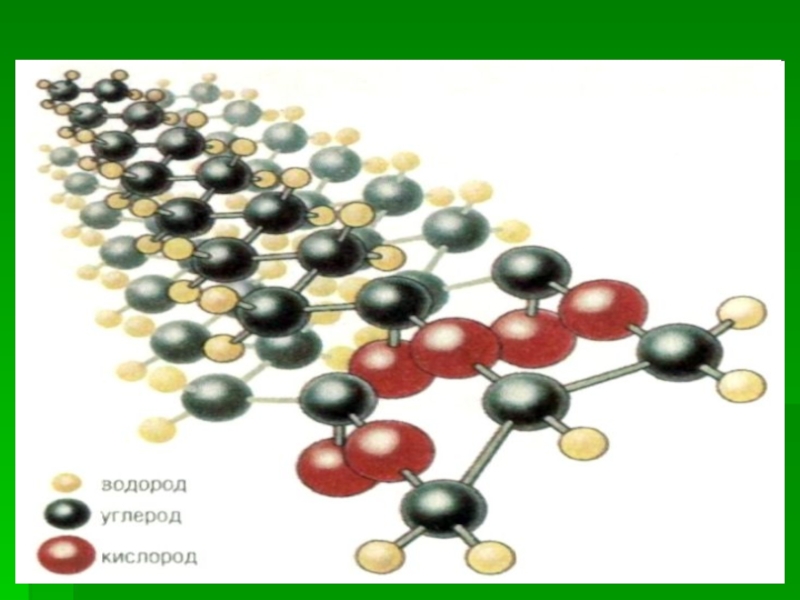
- 7. Строение клеточной мембраны
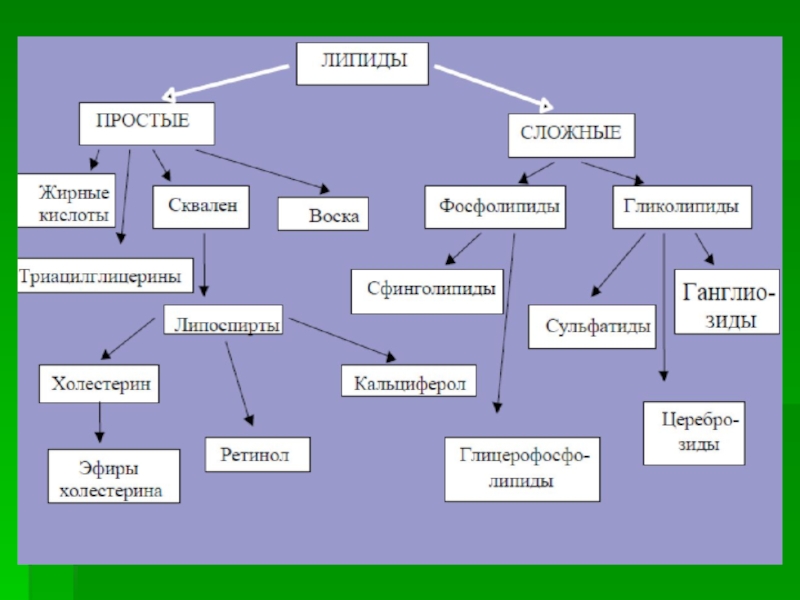
- 8. Классификация липидов.
- 9. Слайд 9
- 10. 1. Жирные кислоты
- 11. 1.Жирные кислоты
- 12. Слайд 12
- 13. Слайд 13
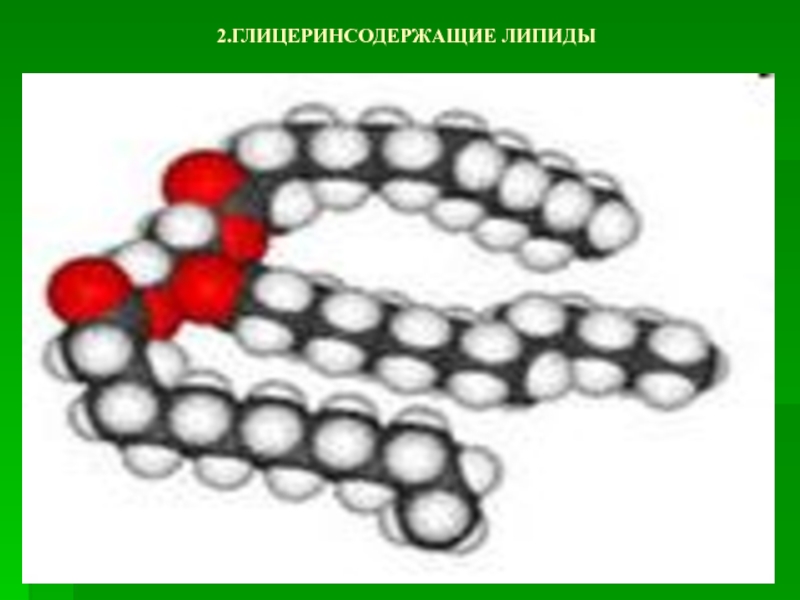
- 14. 2.ГЛИЦЕРИНСОДЕРЖАЩИЕ ЛИПИДЫ
- 15. ГЛИЦЕРИНСОДЕРЖАЩИЕ ЛИПИДЫ
- 16. Слайд 16
- 17. Запасы жира могут покрыть энергетические нужды
- 18. Слайд 18
- 19. 3.ФОСФОЛИПИДЫ
- 20. Фосфолипиды
- 21. Функции фосфолипидов ФЛ - высокоамфифильные
- 22. Функции фосфолипидов ФЛ принимают участие
- 23. Слайд 23
- 24. Слайд 24
- 25. Слайд 25
- 26. Гликолипиды
- 27. СфинголипидыСфинголипиды — это
- 28. Основу сфинголипидов составляет сфигнозин, связанный амидной связью
- 29. Существует 3 основных
- 30. Слайд 30
- 31. Слайд 31
- 32. Слайд 32
- 33. Слайд 33
- 34. Слайд 34
- 35. Слайд 35
- 36. 4.Стероиды
- 37. Стероидывещества животного или, реже, растительного происхождения, обладающие
- 38. Слайд 38
- 39. Слайд 39
- 40. Слайд 40
- 41. ХОЛЕСТЕРИН Суточное
- 42. Функции холестерина понижает жидкостность и
- 43. Функции холестерина является
- 44. Липопротеины - надмолекулярные
- 45. 5.Липопротеиды
- 46. Общее строение липопротеидов
- 47. Слайд 47
- 48. Слайд 48
- 49. Слайд 49
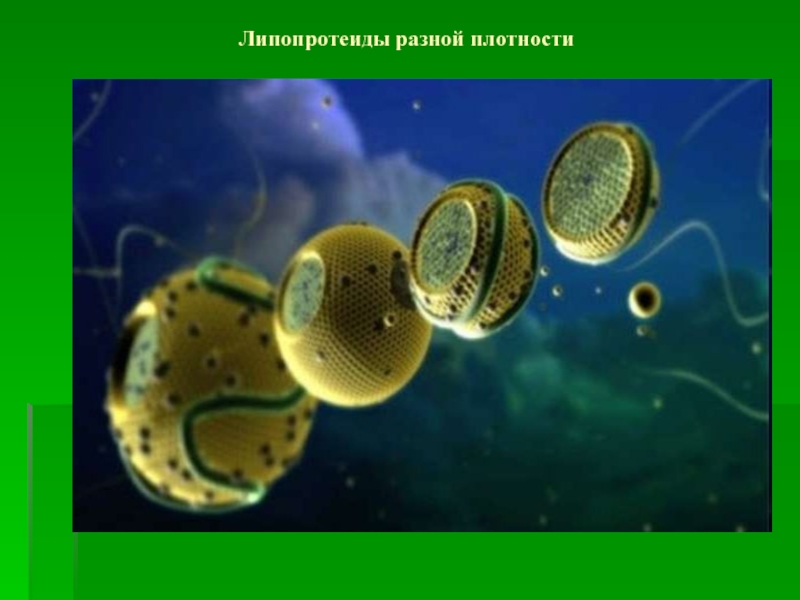
- 50. Липопротеиды разной плотности
- 51. Соотношение состава, плотности, размера липопротеидов.
- 52. Слайд 52
- 53. Соотношение белковой и небелковой части липопротеидов.
- 54. Переваривание и всасывание липидов в 12-перстной кишке.Основные
- 55. Распад смешанной мицеллы в энтероците, всасывание желчных
- 56. Переваривание и всасывание липидов.
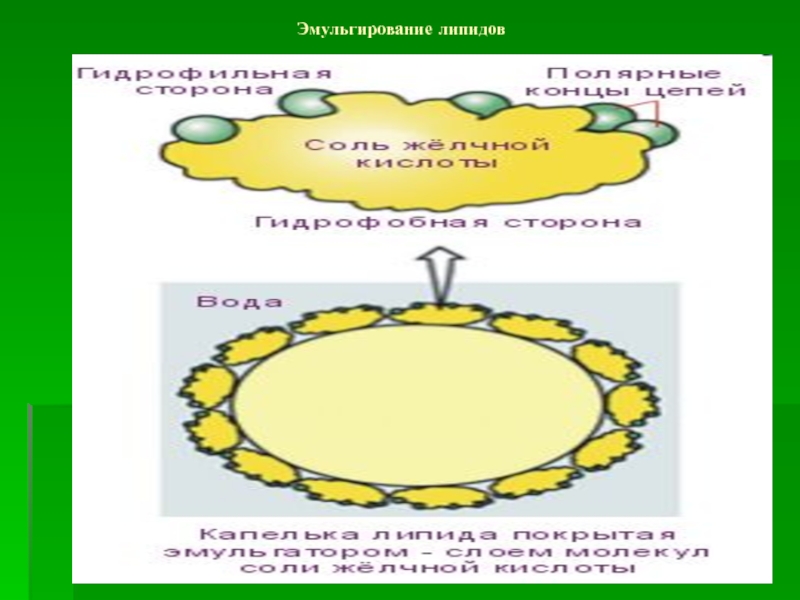
- 57. Эмульгирование липидов
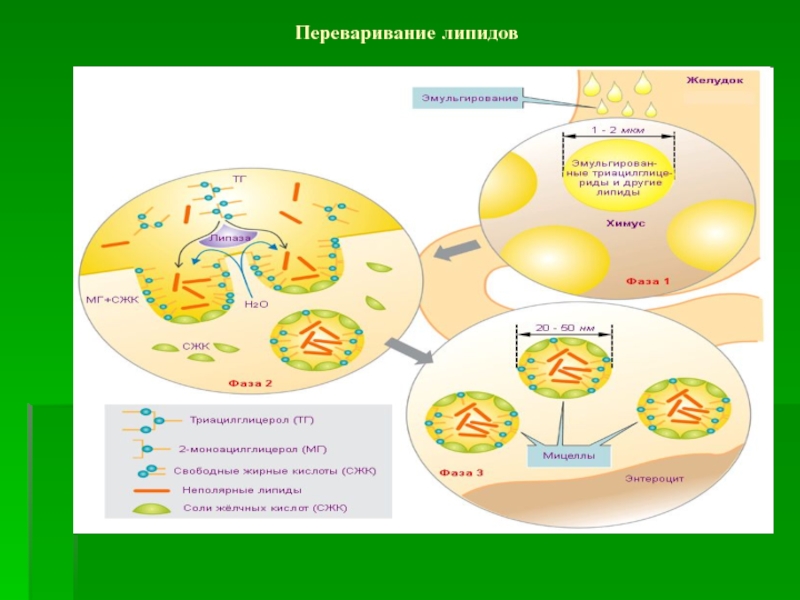
- 58. Переваривание липидов
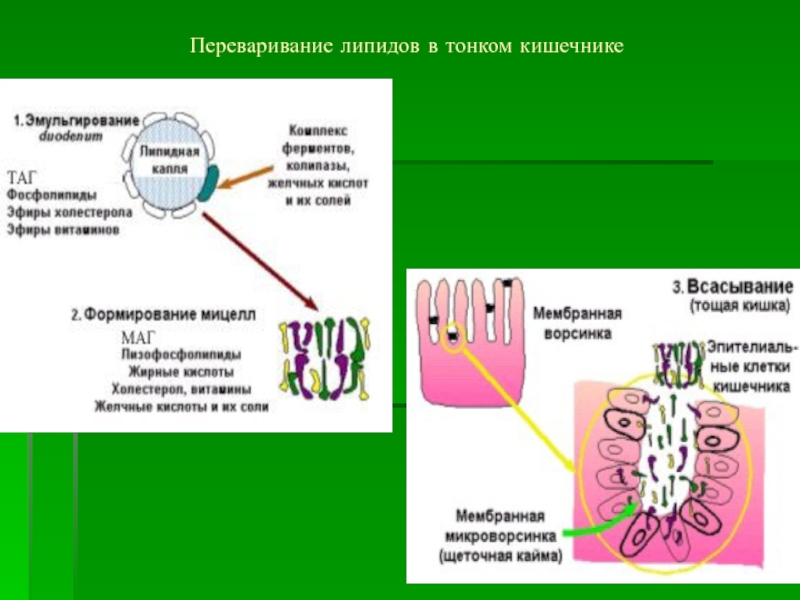
- 59. Переваривание липидов в тонком кишечнике
- 60. Регуляция липидного обмена
- 61. Функции желчи: - Эмульгирование жиров пищи (за
- 62. Состав желчи человека ХолестеролФосфолипидыЖелчные кислоты и их
- 63. Переваривание липидов
- 64. Движение липидов
- 65. липопротеины
- 66. Слайд 66
- 67. Слайд 67
- 68. Слайд 68
- 69. ХОЛЕСТЕРИН Желательный уровень
- 70. Окисление жирных кислотЖирные кислоты во многих тканях
- 71. Окисление жирных кислот
- 72. Слайд 72
- 73. Слайд 73
- 74. Слайд 74
- 75. Синтез триглицеридов Триглицериды синтезируются в стенке кишечника,
- 76. Окисление глицеринаГлицерин сначала фосфорилируется с участием АТФ
- 77. Синтез жирных кислот Синтез жирных кислот протекает
- 78. Метаболизм кетоновых тел Кетоновые тела, являясь продуктами
- 79. Метаболизм фосфолипидов К фосфолипидам относятся глицерофосфолипиды –
- 80. Основные нарушения липидного обмена Нарушения липидного обмена
- 81. Ожирение – это избыточное накопление триглицеридов в
- 82. Гиперлипопротеинемия — повышенное содержание липопротеинов в крови.
- 83. Перекисное окисление липидов – свободнорадикальное окисление липидов,
- 84. Нарушение метаболизма фосфолипидов, как правило, вторично, связано
- 85. При гиперлипопротеинемииI типа хотя содержание холестерина и
- 86. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Функции липидов
Классификация липидов
Переваривание и всасывание липидов
Липопротеины плазмы крови
Окисление жирных кислот
Биосинтез
жирных кислот
Слайд 3· Нерастворимость в воде
· Растворимость в органических растворителях (эфире, спирте,
ацетоне, бензоле и т.д.)
· Наличие в их молекулах высших алкильных
радикалов· Построение молекул по типу сложных эфиров, с участием разных жирных кислот и спиртов
Липиды – это большая группа органических
соединений, для которых характерны
следующие особенности:
Слайд 5Терморегуляторная функция – а)жир плохо проводит тепло б) при охлаждении
на генерирование тепла за счет выделения энергии расходуются все те
же липидыЗащитная (механическая) функция – подкожно-жировая клетчатка
Источник эндогенной воды – при окислении 100 г липидов образуется 107 г воды
Функция естественных растворителей-
всасывание в кишечнике незаменимых жирных кислот и жирорастворимых витаминов.
Слайд 10 1. Жирные кислоты
Насыщенные - не содержат
двойных или тройных связей
Мононенасыщенные - имеют одну двойную связь
Полиненасыщенные - имеют две, три и более двойных или тройных связейСлайд 16
Функции триацилглицеринов
Нейтральный жир - основной энергоресурс организма. Для
того чтобы запасти 10 ккал энергии, достаточно отложить
всего 1,3 г жира
Триацилглицерины человека содержат жирные кислоты с
четным числом атомов углерода. В них широко
представлены мононенасыщенные жирные кислоты, при
этом преобладает олеиновая кислота
15-20% нейтрального жира распределено в виде включений
по различным тканям (конституциональный жир), остальной
жир находится в адипоцитах
Слайд 17 Запасы жира могут покрыть энергетические нужды организма на протяжении
более чем 40 дней
Клетка миокарда для своих энергетических нужд
используютв основном жирные кислоты.
Скопления нейтрального жира выполняют дополнительную
защитную функцию - теплосберегающую,
электроизоляционную, механическую
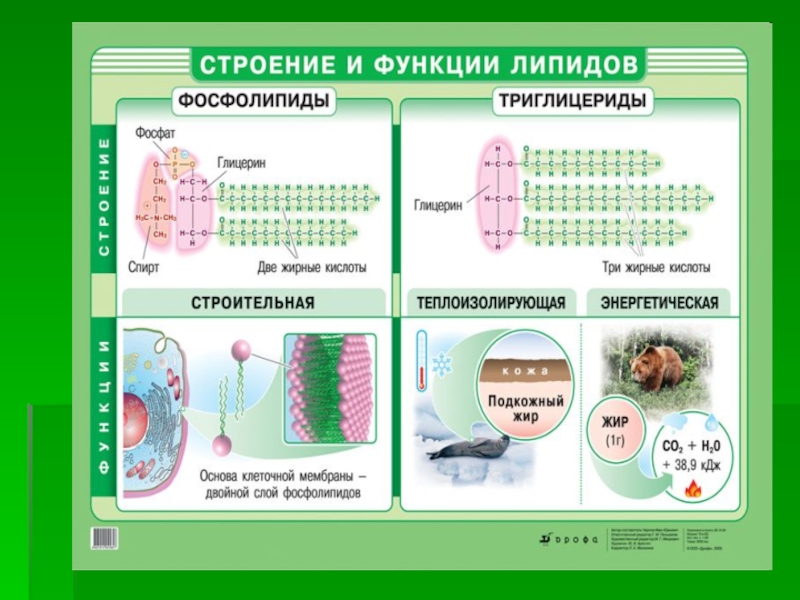
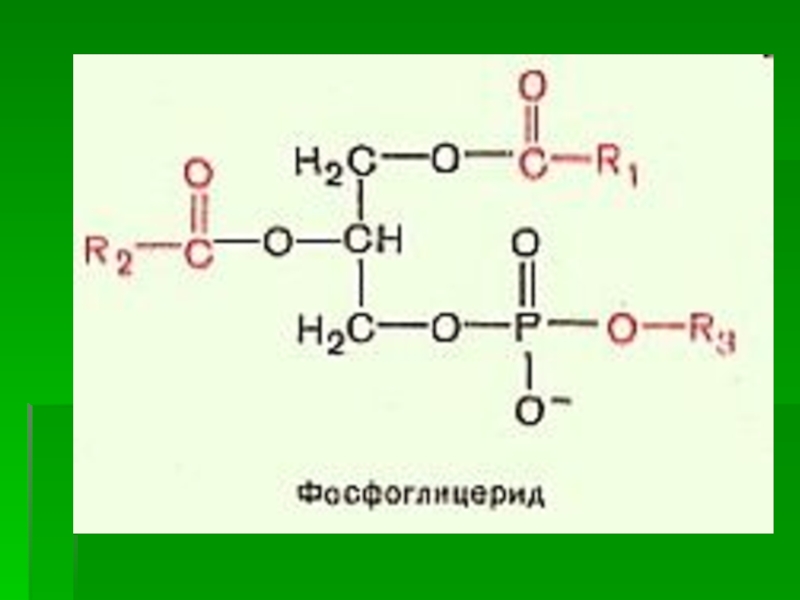
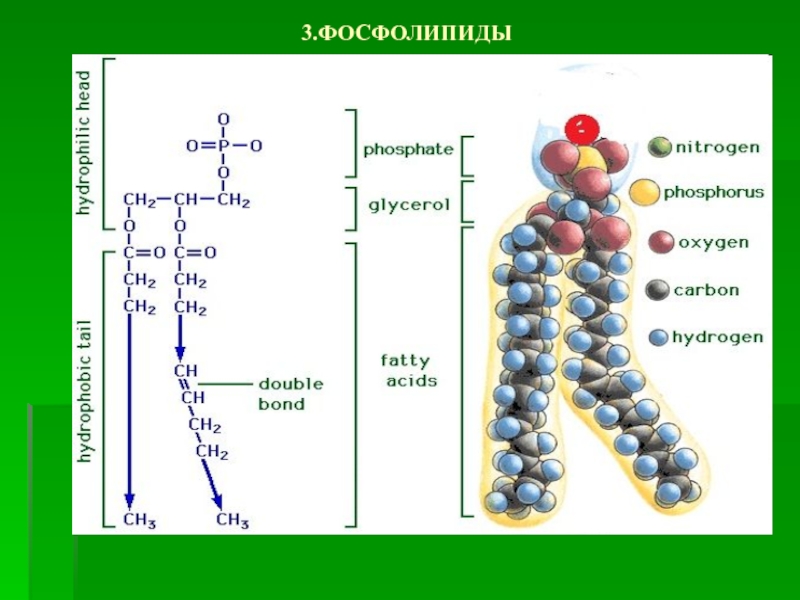
Слайд 20 Фосфолипиды
Фосфолипиды - сложные эфиры
многоатомных спиртов глицерина
(глицерофосфолипиды) либо сфингозина
(сфингофосфолипиды) с высшими жирными и фосфорной
кислотой. В их структуренаходятся еще и азотистые основания
(аминокислота серин или аминоспирты -
холин и этаноламин)
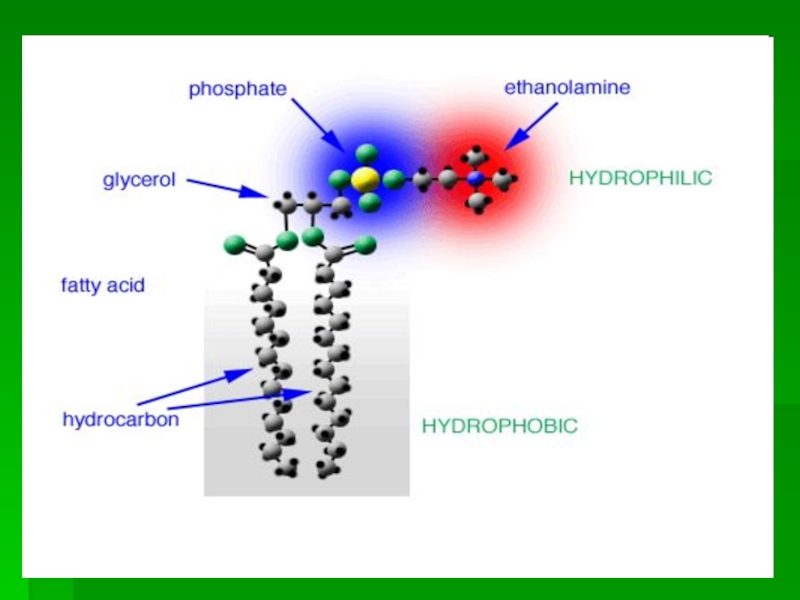
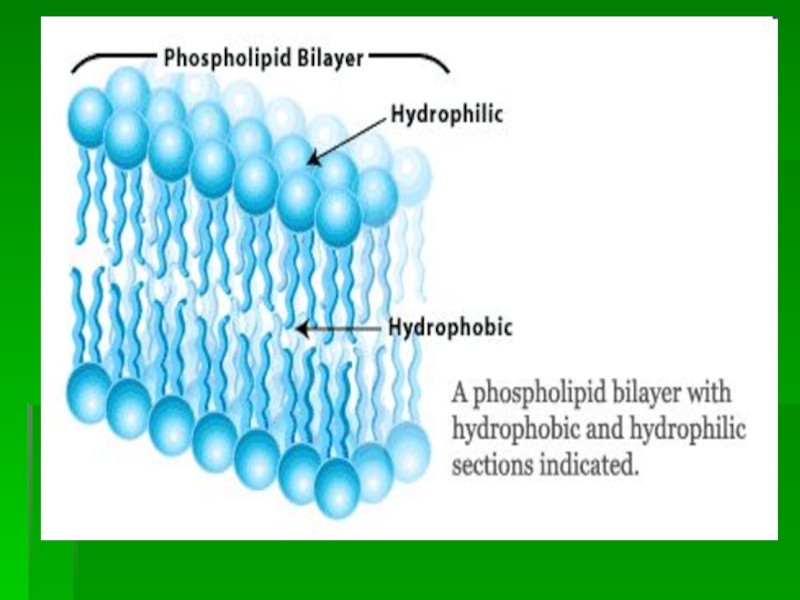
Слайд 21 Функции фосфолипидов
ФЛ - высокоамфифильные соединения. В
биологических мембранах образуют
бислой, на
поверхности липопротеиновых частиц
представлены монослоем
ФЛ в кооперации с холестерином и
мембраннымибелками выполняют барьерную функцию и
регулируют процессы активного переноса веществ
ФЛ регулируют вязкость биологических мембран,
отвечают за стабильность мембран, участвуют в
проведении нервного импульса
Слайд 22 Функции фосфолипидов
ФЛ принимают участие в активации различных ферментов,
в коагулогических реакциях, в процессах клеточной пролиферации и регенерации тканей,
в иммунном ответе.Являются предшественниками биологически активных соединений – эйкозаноидов.
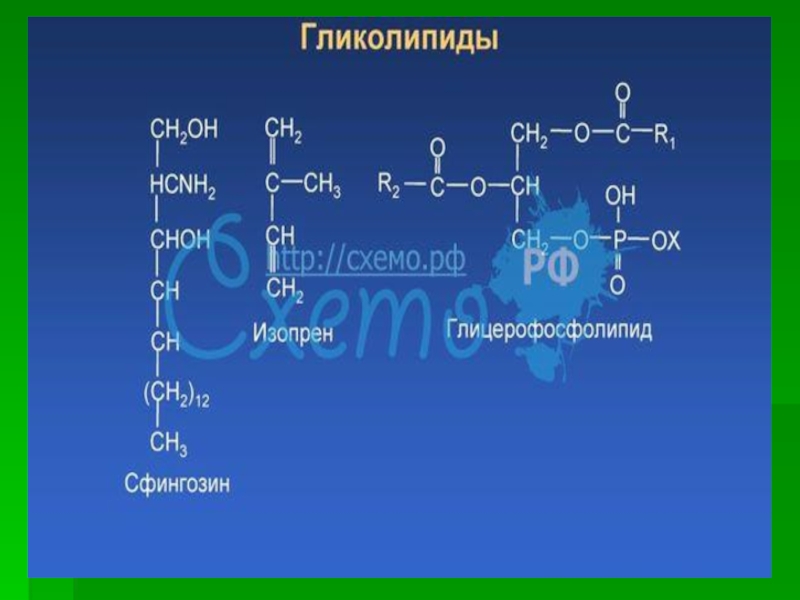
Слайд 25 гликолипиды
Гликолипиды —сложные липиды,
образующиеся в результате соединения липидов с углеводами. В молекулах гликолипидов
есть полярные «головы» (углевод) и неполярные «хвосты» (остатки жирных кислот). Благодаря этому гликолипиды (вместе с фосфолипидами) входят в состав клеточных мембран.Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводные компоненты входят в число других углеводов клеточной поверхности.
Слайд 27 Сфинголипиды
Сфинголипиды — это класс липидов, относящихся
к производным алифатических аминоспиртов. Они играют важную роль в передаче
клеточного сигнала и в клеточном распознавании. Особенно богата сфинголипидами нервная ткань.Слайд 28Основу сфинголипидов составляет сфигнозин, связанный амидной связью с ацильной группой
(например, с жирной кислотой). При этом несколько возможных радикалов связаны
со сфингозином за счёт эфирной связи. Простейший представитель сфинголипидов — церамид.Слайд 29 Существует 3 основных типа сфинголипидов:
Церамиды —
это наиболее простые сфинголипиды. Они содержат только сфингозин, соединённый с
жирнокислотным ацильным остатком.Сфингомиелины содержат заряженную полярную группу, такую как фосфохолин или фосфоэтаноламин.
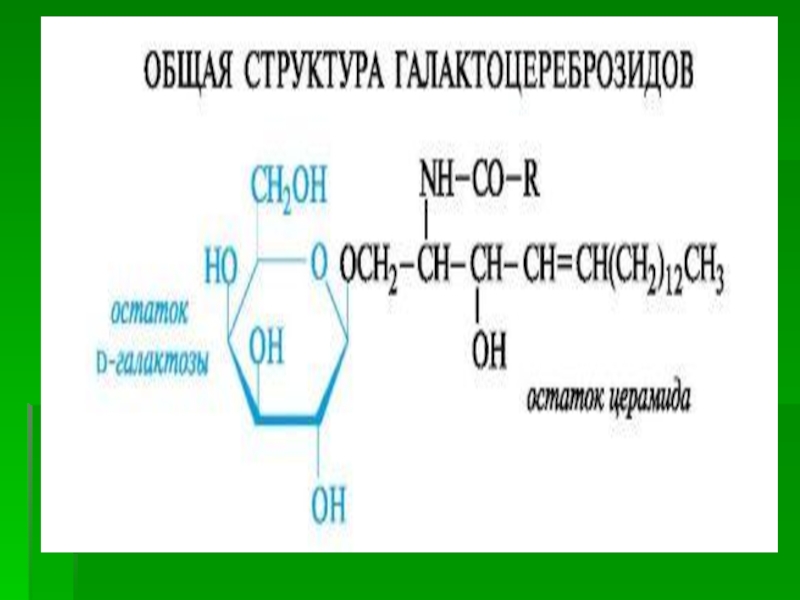
Гликосфинголипиды содержат церамид, этерифицированный по 1-гидрокси-группе остатком сахара. В зависимости от сахара гликосфинголипиды подразделяются на цереброзиды и ганглиозиды.
Цереброзиды содержат в качестве остатка сахара глюкозу или галактозу.
Ганглиозиды содержат трисахарид, причём один из них всегда сиаловая кислота.
Слайд 37Стероиды
вещества животного или, реже, растительного происхождения, обладающие высокой биологической активностью.
Стероиды образуются в природе из изопреноидных предшественников. Особенностью строения стероидов
является наличие конденсированной тетрациклической системы гонана (прежнее название — стеран). Ядро гонана в стероидах может быть насыщенным или частично ненасыщенным, содержать алкильные и некоторые функциональные группы — гидроксильные, карбонильные или карбоксильную[1].В регуляции обмена веществ и некоторых физиологических функций организма участвуют стероидные гормоныВ регуляции обмена веществ и некоторых физиологических функций организма участвуют стероидные гормоны. Ряд синтетических гормонов, например, преднизолон, по действию на организм превосходят природные аналоги. В группу стероидов входят содержащиеся в организме человека стероидный спирт холестерин холестерин, а также жёлчные кислоты холестерин, а также жёлчные кислоты — соединения, имеющие в боковой цепи карбоксильную группу, например, холевая кислота.
К стероидам относятся также сердечные гликозидыК стероидам относятся также сердечные гликозиды — вещества растительного происхождения (из наперстянкиК стероидам относятся также сердечные гликозиды — вещества растительного происхождения (из наперстянки, строфантаК стероидам относятся также сердечные гликозиды — вещества растительного происхождения (из наперстянки, строфанта, ландышаК стероидам относятся также сердечные гликозиды — вещества растительного происхождения (из наперстянки, строфанта, ландыша), регулирующие сердечную деятельность. В гликозидах стероидный фрагмент соединен гликозидной связью с олигосахаридом[2].
Стероидогенез — биологический процесс, при котором стероиды образуются из холестерина и превращаются в другие стероиды.
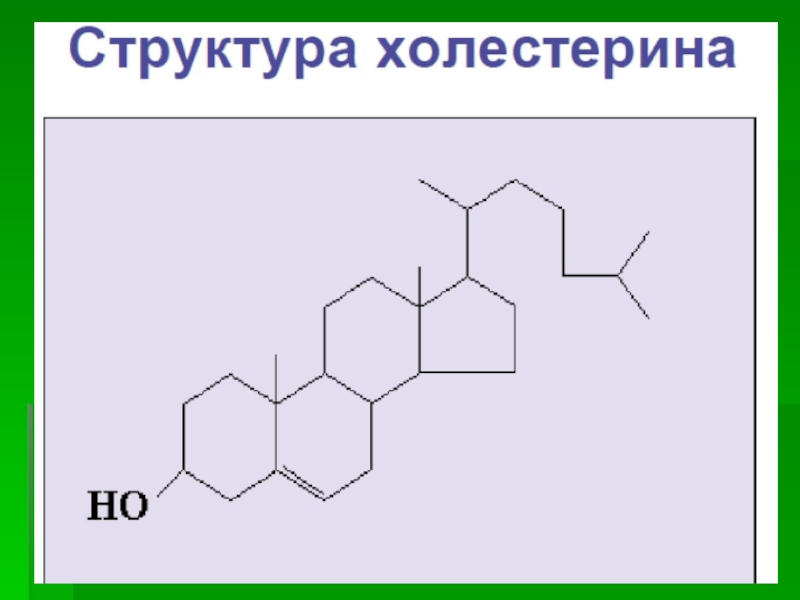
Слайд 41 ХОЛЕСТЕРИН
Суточное потребление холестерина находится в
диапазоне
от 0,2 до 0,5 г
В организме ежедневно синтезируется более
1 гВсе клетки организма содержат его в составе своих
мембран и теоретически способны его
синтезировать. Общее количество холестерина в
теле человека огромно - более 300 г
Холестерин в связанной с жирными кислотами
форме содержится в надпочечниках, гонадах (83%),
в плазме крови (70%). В остальных тканях - в
основном в свободном виде
Слайд 42 Функции холестерина
понижает жидкостность и проницаемость
биологических мембран
участвует в обеспечении
барьерной функции мембран
влияет на активность мембранных ферментов
избыток холестерина в цитоплазматической
мембране затрудняет работу кальциевых насосовСлайд 43 Функции холестерина
является предшественником стероидных
гормонов надпочечников и
половых
гормонов, витамина Д
окисляясь, превращается в желчные
кислоты и выводится из организма
недостаток
холестерина в организмеспособствует повышенному риску развития опухолевых и вирусных заболеваний
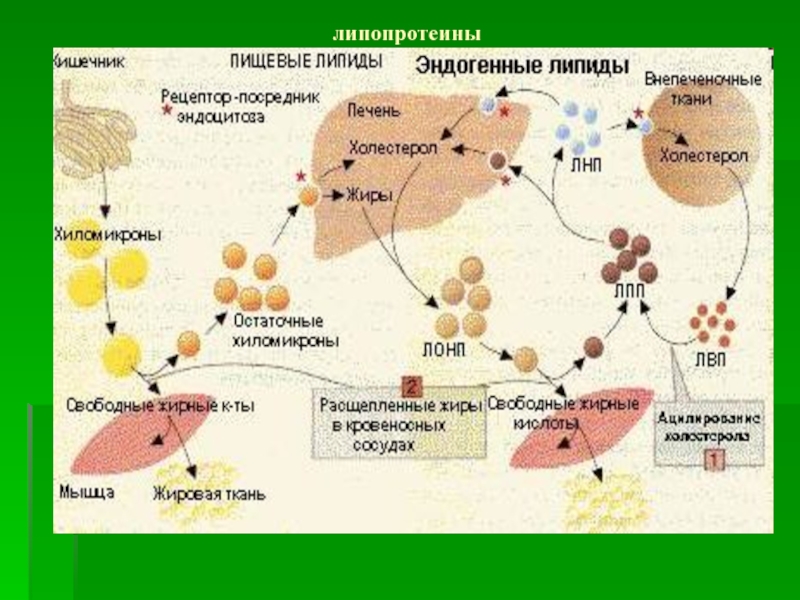
Слайд 44 Липопротеины - надмолекулярные образования, основанные на
нековалентных
связях
Частицы ЛП имеют сферическую форму и состоят
из
гидрофильной оболочки и гидрофобного ядраГидрофобное ядро представлено неполярными
триацилглицеринами и эфирами холестерина
Гидрофильная оболочка - это верхний мозаичный
монослой, состоящий из фосфолипидов,
свободного холестерина и апопротеинов
Гидрофильная оболочка обеспечивает
растворимость ЛП и определяет пути метаболизма и судьбу каждого ЛП (благодаря апопротеинам)
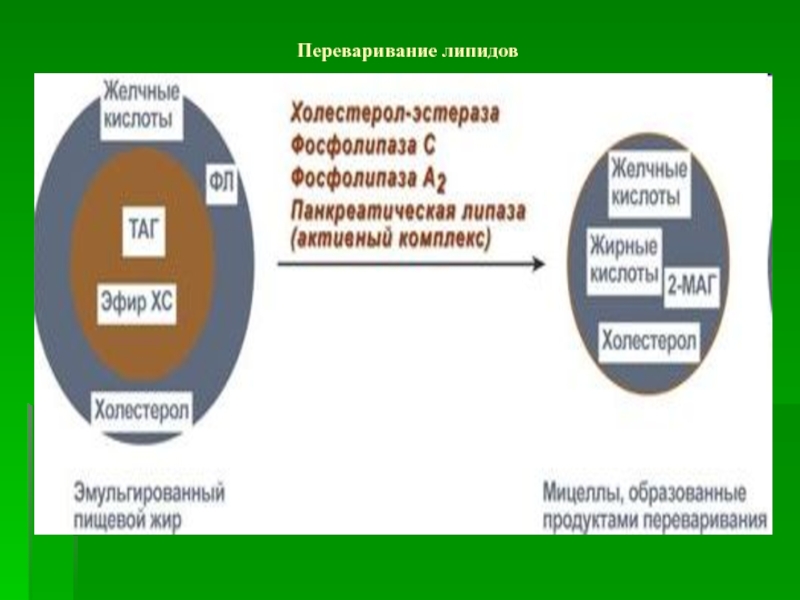
Слайд 54Переваривание и всасывание липидов в 12-перстной кишке.
Основные этапы:
Эмульгирование – из
крупной капли липидов образуется 10/12 мелких капель
Гидролиз липидов – под
влиянием ферментов (панкреатической кишечной липаз, фосфолипаз,холестеролэстеразы и др.)Образование смешанных мицелл из простой мицеллы и продуктов гидролиза
Транспорт и всасывание смешанной мицеллы в энтероците кишечника
Слайд 55Распад смешанной мицеллы в энтероците, всасывание желчных кислот и их
солей в кровь с последующей доставкой в печень – энтерогепатический
циклРесинтез ТАГ в энтероцитах слизистой ЖКТ
Образование транспортных форм липидов в энтероцитах слизистой ЖКТ.
Попадание ХМ и ЛПОНП через лимфатическую систему в грудной лимфатический проток, а затем в общий круг кровообращения к тканям с активной липопротеинлипазой.
Слайд 61Функции желчи:
- Эмульгирование жиров пищи (за счет желчных кислот);
- Нейтрализация
кислоты желудочного сока;
- Активация пищеварительных ферментов поджелудочной железы и кишечного
сока;- Бактерицидное действие (неспецифические Ig A);
- Активация моторики кишечника;
- Всасывание высших жирных кислот;
- Выведение продуктов обмена веществ из организма.
Слайд 62Состав желчи человека
Холестерол
Фосфолипиды
Желчные кислоты и их соли в том числе:
-
45 % холат
- 25 % дезоксихолат
- 30 % хенодезоксихолат
частично связаны
с глицином и тауриномСлайд 69 ХОЛЕСТЕРИН
Желательный уровень - менее 5,2 ммоль/л
Пограничный
уровень - 5,2-6,2 ммоль/л
Критический уровень - более 5,2 ммоль/л
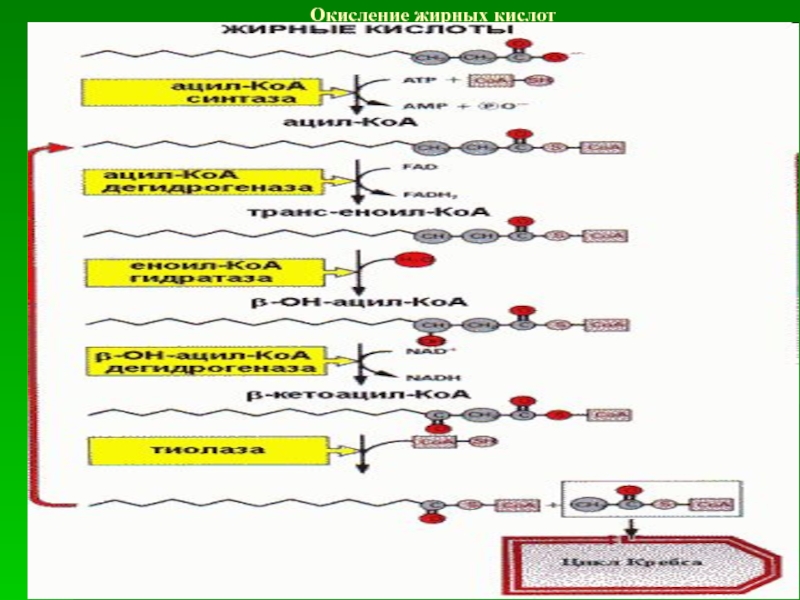
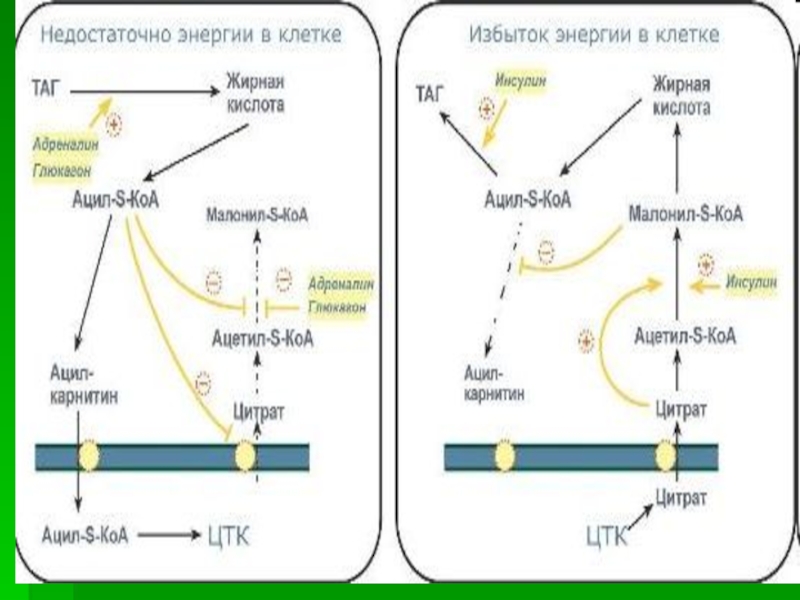
Слайд 70Окисление жирных кислот
Жирные кислоты во многих тканях (в первую очередь
в скелетных мышцах и миокарде) вовлекаются в специфический процесс –
b-окисление, протекающее в митохондриях. Все превращения ЖК начинаются с их активации — образования ацил-КоА.Мембрана митохондрий непроницаема для жирных кислот, в том числе и в форме ацил-КоА. Их перенос обеспечивается карнитином.
В митохондриях на митохондриальном матриксе происходит окисление жирных кислот, сопряженное с окислительным фосфорилированием (с синтезом АТФ). b-окисление протекает по следующей схеме:
В первой реакции происходит дегидрирование при участии ФАД-зависимой дегидрогеназы. Затем присоединение воды (гидроксил – в b-положение) с образованием b-гидроксиацил-КоА. Дегидрирование НАД-зависимой дегидрогеназой у b-углеродного атома приводит к образованию b-кетоацил-КоА. Заключительный этап катализирует тиолаза, расщепляющая тиосвязь с участием HS-Коэнзима-А, что приводит к образованию ацетил-КоА и ацил-КоА с укороченной на два углеродных атома цепью.
Ацетильный остаток ацетил-КоА окисляется в цикле Кребса, укороченная жирная кислота вовлекается в повторный цикл b-окисления. В конечном счете, она распадается на такое количество остатков ацетила, которое в два раза меньше числа атомов углерода в ней.
При окислении жирных кислот с нечетным количеством углеродных атомов на последнем цикле b-окисления образуется ацетил-КоА и активная форма пропионовой кислоты (пропионил-КоА). Пропионил-КоА карбоксилируется до метилмалонил-КоА и изомеризуется в сукцинил-КоА. Последний поступает в ЦТК.
Слайд 75Синтез триглицеридов
Триглицериды синтезируются в стенке кишечника, в печени и жировой
ткани (в адипоцитах).
Синтез триглицеридов в стенке кишечника может происходить из
моноглицерида (из 2-моноацилглицерола) и двух молекул активных жирных кислот (остатки жирных кислот в комплексе с ацилпереносящим энзимом – S-КоА), или из глицерина и трех молекул активных жирных кислот с участием АТФ, что более характерно для процессов в печени и жировой ткани.Синтез жира из глицерина и жирных кислот в печени и жировой ткани происходит по следующему пути. Глицерин фосфорилируется с использованием АТФ до глицерофосфата (фермент глицеролкиназа), затем под действием фермента глицеролфосфатацилтрансферазы взаимодействует с двумя молекулами ацилкоэнзима-А (например, с пальмитил-КоА). Образуется фосфатидная кислота (3-фосфо-1,2-диацилглицерол). При взаимодействии последней с ацилкоэнзимом-А образуется триглицерид, свободный HS-КоА и остаток ортофосфорной кислоты.
Печень – основной орган, где идет синтез жирных кислот из продуктов гликолиза. Основной путь синтеза триглицелидов в печени из жирных кислот и глицерофосфата. Глицерофосфат, в свою очередь, в печень поступает из гидролиза жиров, а так же при восстановлении диоксиацетонфосфата (из гликолиза) при помощи восстановленного НАДФ (НАДФ Н+Н).
Слайд 76Окисление глицерина
Глицерин сначала фосфорилируется с участием АТФ до глицерофосфата (3-фосфоглицерол).
Затем под действием НАД-зависимой
глицерофосфатдегидрогеназы окисляется до 3-фосфоглицеринового альдегида.
Фосфоглицериновый
альдегид далее может окисляться до пировиноградной и молочной кислоты.Слайд 77Синтез жирных кислот
Синтез жирных кислот протекает в цитозоле из Ацетил-КоА,
образовавшегося в митохондриях при гликолизе. Для использования ацетилкоэнзима-А в процессах,
протекающих в цитоплазме клетки, протекает ряд реакций для переноса Ацетил-КоА через митохондриальную мембрану.В митохондриях ацетил-КоА взаимодействует со Щавелевоуксусной кислотой (ЩУК), образуется лимонная кислота. В цитоплазме протекает обратный процесс. Таким образом, в цитоплазме образуется Ацетил-КоА.
Для синтеза жирных кислот протекает еще ряд последовательных реакций, образуется малонил-КоА. Ацетильная и малонильная группы переносятся на АПБ при участии ацетил-и малонил-трансацилаз. АПБ — ацилпереносящий белок. Далее к Ацетил-АПБ прибавляется Малонил-АПБ с образованием Ацетоацетил-АПБ. Наступает цикл реакций, противоположных бета-окислению жирных кислот, но вместо КоА носителем является АПБ, а вместо НАД и ФАД в процессах гидрирования участвует НАДФН2.
Бутирил-АПБ вступает в новый цикл (взаимодействует с малонил-АПБ), в результате которого углеродная цепь удлиняется на 2 атома. Циклы повторяются, пока цепь включит 16 атомов углерода (пальмитиновая кислота) или большего четного числа.
Слайд 78Метаболизм кетоновых тел
Кетоновые тела, являясь продуктами жирового обмена, выполняют в
организме функцию энергетического субстрата, т.е. источника энергии. К кетоновым телам
относят b-гидроксимасляную кислоту, ацетоуксусную кислоту и, как конечный (тупиковый) продукт – ацетон (диметилкетон). Это небольшие водорастворимые молекулы. Общая концентрация кетоновых тел в крови млекопитающих составляет около 5 мг% (у жвачных животных до 10 мг%). Синтезируются кетоновые тела в печени (в гепатоцитах) из ацетил-КоА. У жвачных животных отмечают также синтез кетоновых тел в слизистой оболочке преджелудков.При выраженном углеводном голодании (белковый и белково-жировой рацион с недостатком углеводов), при нарушениях обмена углеводов (сахарный диабет) в результате клеточного голодания усиливается распад и использование жиров, что приводит к накоплению ацетил-КоА. Излишек молекул ацетил-КоА вовлекается в синтез кетоновых тел. Резкое увеличение концентрации кетоновых тел в крови приводит к развитию кетозов и кетоацидозов.
Для синтеза кетоновых тел используется три молекулы ацетил-КоА. При конденсации двух молекул ац.-КоА образуется ацетоацетил-КоА; затем добавление третьей молекулы приводит к образованию b-гидрокси-b-метил-глютарил-КоА. При этих реакциях освобождается две молекулы HS-КоА. Полученная молекула b-гидрокси-b-метил-глютарил-КоА под действием лиазы распадается на ацетоуксусную кислоту и ацетил-КоА. Все указанные реакции протекают в матриксе митохондрий гепатоцитов.
В цитоплазме клеток ацетоуксусная кислота при участии НАД-зависимой дегидрогеназы (НАДФ*Н2) может восстанавливаться до b-гидроксимасляной кислоты или спонтанно декарбоксилироваться с образованием ацетона (диметилкетона).
Слайд 79Метаболизм фосфолипидов
К фосфолипидам относятся глицерофосфолипиды – производные фосфатидной кислоты, и
сфингофосфолипиды.
Основными компонентами фосфолипидов являются кефалин, лецитин, фосфатидилсерин и сама фосфатидная
кислота.Метаболизм фосфолипидов тесно связан со многими процессами в организме: образование и разрушение мембранных структур клеток, формирование липротеинов, мицелл желчи, образование в легочных альвеолах поверхностных пленок (сульфоктанта) препятствующих слипание альвеол. Нарушение обмена фосфолипидов – причина развития многих заболеваний (липидоз печени, респираторный дистресс-синдром).
Слайд 80Основные нарушения липидного обмена
Нарушения липидного обмена могут быть как первичными,
так и вторичными, т.е. вызванными патологией эндокринной системы или компенсаторные
при различных заболеваниях.Нарушения переваривания и всасывания липидов сопровождаются развитием стеатореи (повышенное содержание липидов и жирных кислот в кале) и обусловливаются одной из следующих причин:
1.Дефицит панкреатической липазы, связанный с заболеваниями поджелудочной железы.
2.Дефицит желчи в кишечнике, обсуловленный заболеваниями печени или желчевыводящих путей.
3.Угнетение ферментных систем ресинтеза триглицеридов в стенке кишечника при его заболеваниях.
Слайд 81Ожирение – это избыточное накопление триглицеридов в организме. Ожирением считается
увеличение массы тела более чем на 20 % от идеальной для
данной особи. Первичное ожирение связано, в первую очередь, с избыточным кормлением, когда организм получает больше калорий, чем расходует. У некоторых животных повышение аппетита имеет генетическую обусловленность (генетические нарушения синтеза лептина). «Ген ожирения» обнаружен у приматов, крыс, свиней, собак. Следует отметить, что кроме генетических нарушений синтеза лептина могут быть и приобретенные. Значительную роль играет «привычка», так при перекармливании растущих животных снижается эффективность лептина на фоне психологической реакции на корм. Причиной ожирения может быть и резкое прекращение физических нагрузок у спортивных и рабочих животных при сохранении калорийного рациона.Вторичное ожирение наблюдается при эндокринных болезнях (гипотиреоз, синдром Иценко-Кушинга, гипогонадизм и др.).
Кетоз (кетоацидоз) – накопление в крови и во всем организме кетоновых тел в избыточном количестве. Причиной такого накопления является нарушение углеводного обмена, невозможность использования глюкозы для получения энергии в клетке. У жвачных животных наиболее частое развитие кетоза связано с несбалансированным концентратным типом кормления. У плотоядных (особенно кошек) основной причиной кетоза является сахарный диабет. Так именно кетоацидоз у кошек является наиболее частой причиной гибели при сахарном диабете.
Слайд 82Гиперлипопротеинемия — повышенное содержание липопротеинов в крови. Различают несколько типов,
в зависимости от причины и преобладающих липопротеинов. Так при нарушении
липопротеинлипазы (фермент клеточных мембран, необходимый для поступления в клетку триглицеридов из хиломикронов крови) в крови накапливаются хиломикроны и триглицериды. Резкое увеличение в крови ЛПОНП наблюдается при гиперинсулинизме (избытке инсулина), т.к. инсулин стимулирует синтез триглицеридов в печени.Липидоз печени – накопление жировых капель в гепатоцитах, ожирение печени. Связано с нарушением синтеза фосфолипидов и апопротеинов (белковых компонентов липопротеинов крови), в сочетании с избыточным поступлением жирных кислот, глицерина, триглицеридов в печень и с повышением синтеза триглицеридов в печени. Такое состояние может развиваться при активной мобилизации жира при одновременном недостатке метионина и холина. Основной причиной липидоза печени служит нарушение баланса между активностью синтеза триглицеридов в печени и скоростью их включения в структуру ЛПОНП, т.е. недостаточный синтез липопротеинов очень низкой плотности, что может быть связано с нарушением синтеза апопротеинов (апоВ100 и апоАII) или с недостаточностью лецитина. У кошек выделяют липидоз печени, как самостоятельное заболевание (гепатический липидоз), связанное с внезапным голоданием.
Слайд 83Перекисное окисление липидов – свободнорадикальное окисление липидов, вызванное пероксидным ионом.
При изучении процессов биологического окисления рассматривается вариант короткой цепи окисления
– перекисное окисление. Кроме полезного действия (например разрушение мембран фагоцитированных микробов в лейкоцитах) при спонтанном образовании перекиси, образовавшийся пероксидный ион способен вступать в реакцию со многими молекулами. В белках окисляются некоторые аминокислоты, активные формы кислорода легко нарушают и структуру ДНК. Перекисное окисление липидов – это цепные реакции, обеспечивающие расширенное воспроизводство свободных радикалов, частиц, имеющих неспаренный электрон, которые инициируют дальнейшее распространение перекисного окисления. В клетке присутствует довольно развитая система защиты от перекисного окисления (антиоксидантная система), включающая ферменты, нейтрализующие перекиси и свободные радикалы (каталаза, глютатионредуктаза) и молекулы «ловушки» свободных радикалов и активных ионов (мембранная система витамина Е и селена, глютатион, аскорбиновая кислота). Наиболее развита антиоксидантная система в клетках, больше подверженных окислению, где выше парциальное давление кислорода, например, эритроциты, лейкоциты, эпителиальные клетки дыхательных путей. При несостоятельности антиоксидантной системы перекисное повреждение липидов приводит к повреждению мембранных структур клетки, что нарушает функционирование клетки и является основным механизмом гибели клетки.Слайд 84Нарушение метаболизма фосфолипидов, как правило, вторично, связано с перекисным повреждением,
либо с нарушением обмена отдельных аминокислот (метионина, таурина, серина). В
качестве самостоятельной патологии не рассматривается, приводит к нарушению печени (липидоз), нарушению транспорта липидов в организме (гиполипидемии, или выпадение триглицеридов в осадок на стенках сосудов), снижению растворимости холестерина желчи и нарушение реологических (увеличение вязкости) свойств желчи (появление «пыли» и желчных камней). Все эти состояния могут быть связаны с недостаточностью полиненасыщенных жирных кислот (эсенциальных кислот), которые входят в состав фосфолипидов.Нарушения холестеринового обмена хорошо изучены у человека, но значительно меньше у животных. Для медицины человека наибольшее значение имеет атеросклероз. Это патология связана с нарушением соотношения липопротеинов низкой и высокой плотности, в результате чего развивается увеличение количества холестерина в организме (при этом абсолютное содержание холестерина в крови может быть не повышено). Холестерин ввиду низкой растворимости выпадает в осадок, накапливается в клетках и в интиме сосудов, что приводит к пролиферации клеток (они пытаются израсходовать избыток холестерина на построение дополнительных мембран). Так формируются холестериновые «бляшки» и холестериноз сосуда (увеличение содержания холестерина в стенке сосуда в клетках) переходит в атеросклероз. Главной причиной развития атеросклероза является нарушение выведения холестерина из организма и одновременное увеличение его синтеза в гепатоцитах, что обусловлено неправильным восприятием клеткой липопротеинов низкой плотности (генетические или иммунологические нарушения структуры рецепторов к апопротеинам, либо модификация белковых компонентов липопротеинов). В ответ на нарушение этого восприятия в печени усиливается синтез холестерина, что приводит к еще большему накоплению его в организме. Избыток поступления холестерина с кормом и повреждение проницаемости сосудов являются лишь способствующими факторами накопления холестерина и формирования бляшки.
У плотоядных животных, ввиду особенностей захвата ЛПНП и выведения холестерина, первичного атеросклероза не наблюдается, однако при некоторых эндокринных болезнях (гипотиреоз) возможно развитие вторичных нарушений холестеринового обмена с формированием холестериновых бляшек.
Слайд 85При гиперлипопротеинемииI типа хотя содержание холестерина и триглицерида повышено, но
атеросклероза нет, так как хиломикроны не обладают атерогенностью. Липопротеинемия этого
типа встречается очень редко. Клинически она проявляется в виде ксантоматоза, в некоторых случаях отмечается липидная дуга роговицы. Нередко наблюдаются увеличение печени и селезенки, абдоминальная колика. Гиперлипопротеинемия I типа обычно наблюдается у детей.Гиперлипопротеинемия II типа характеризуется наиболее высокой гиперхолестеринемией. Содержание триглицеридов крови может быть либо нормальным, либо повышенным. При гиперлипопротеинемии 2А типа содержание ЛПНП повышено, а ЛПОНТ — нормально; при 2Б — содержание ЛПНП и ЛПОНП повышено.
При гиперлипопротеинемии II типа нередко наблюдается ишемическая болезнь сердца, при этом у лиц с гомозиготной наследственностью она возникает рано и часто является причиной преждевременной смерти.
Гиперлипопротеинемия третьего типа сочетается с ишемической болезнью сердца и поражением сосудов ног. При высоком содержании липидов в крови наблюдаются бугорчатые ксантомы, располагающиеся на ладонях. Сыворотка прозрачная или мутная. Гиперлипопротеинемия III типа встречается значительно реже, чем II типа, и нередко сочетается с сахарным диабетом.
Гиперлипопротеинемия IV типа характеризуется высоким содержанием в крови триглицеридов при нормальном или относительно невысоком уровне холестерина. При этом типе отмечается повышение уровня ЛПОНП, в ряде случаев она протекает с диабетом и ожирением. Гиперлипопротеинемия IV типа развивается в зрелом возрасте и довольно широко распространена, причем у мужчин она наблюдается чаще.
При V типе гиперлипопротеинемии наблюдается высокая концентрация хиломикронов и триглицеридов. Клинически она проявляется так же, как и гиперлипопротеинемия I типа, иногда сочетаясь со скрытым или умеренно выраженным диабетом. Ишемическая болезнь сердца при гиперлипопротеинемии V типа наблюдается реже, чем при II, III и IV типах. Первичная гиперлипопротеинемия V типа не имеет широкого распространения и встречается только у взрослых.