Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Адсорбция на твердых телах
Содержание
- 1. Адсорбция на твердых телах
- 2. План лекцииВиды адсорбцииФакторы, влияющие на скорость адсорбции
- 3. Немного истории…Ловиц Т.Е., Шееле – первое учение
- 4. Поверхность твердого телаТвердыми телами могут адсорбироваться газы
- 5. Особенности адсорбцииНа активном центре адсорбируются молекулы, как
- 6. Виды адсорбцииПо механизму адсорбционных сил:Физическая – осуществляется
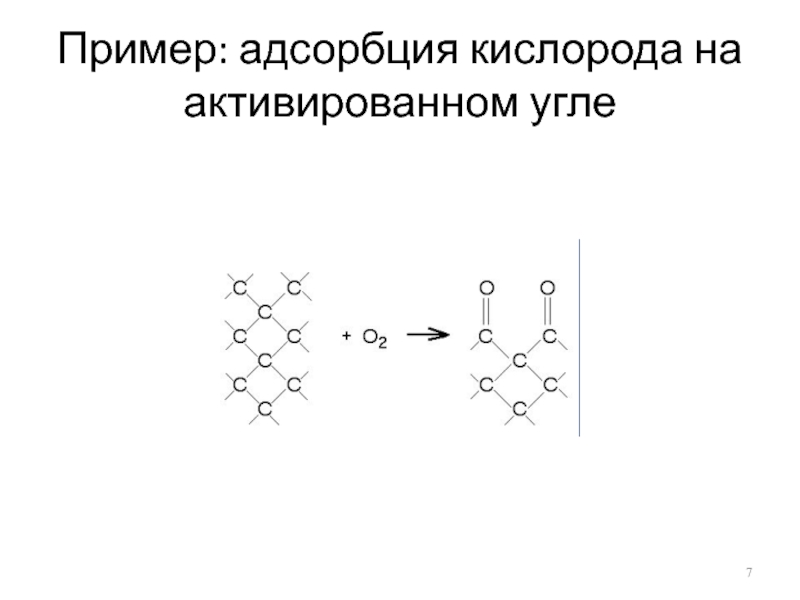
- 7. Пример: адсорбция кислорода на активированном угле
- 8. Факторы, влияющие на скорость адсорбции газов и
- 9. Природа веществНеполярные адсорбенты хорошо адсорбируют неполярные веществаПолярные
- 10. Величина удельной поверхности SSудель = -------- mЧем выше величина
- 11. Температура и давлениеАдсорбция – процесс экзотермический; повышение
- 12. Изотерма адсорбцииI – адсорбция прямо пропорциональна концентрацииII
- 13. Уравнение ФрейндлихаГ = КФ · С nКФ
- 14. lgГ = lgКФ + n lgC Недостатки
- 15. Уравнение Ленгмюра и его анализ
- 16. Особенности адсорбции из растворовЗависит от способности к
- 17. Величина адсорбции (С0 –
- 18. Правило РебиндераНа полярных адсорбентах лучше адсорбируются полярные
- 19. Особенности адсорбции из растворов электролитовВ механизме адсорбции
- 20. Величина заряда ионаМноговалентные ионы адсорбируются лучше одновалентных
- 21. Правило Панета-Фаянса-ПесковаНа твердом адсорбенте адсорбируется тот ион,
- 22. Значение адсорбции для биологических процессовВсе ферментативные реакции
- 23. Обменная адсорбцияВытеснение одного сорбтива другим более сильным
- 24. Гемосорбция – очистка крови от токсинов и
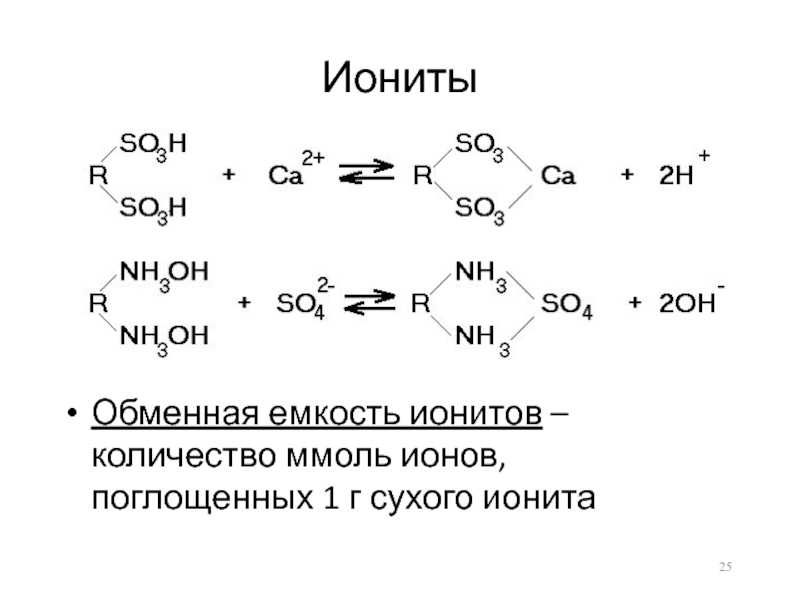
- 25. ИонитыОбменная емкость ионитов – количество ммоль ионов, поглощенных 1 г сухого ионита
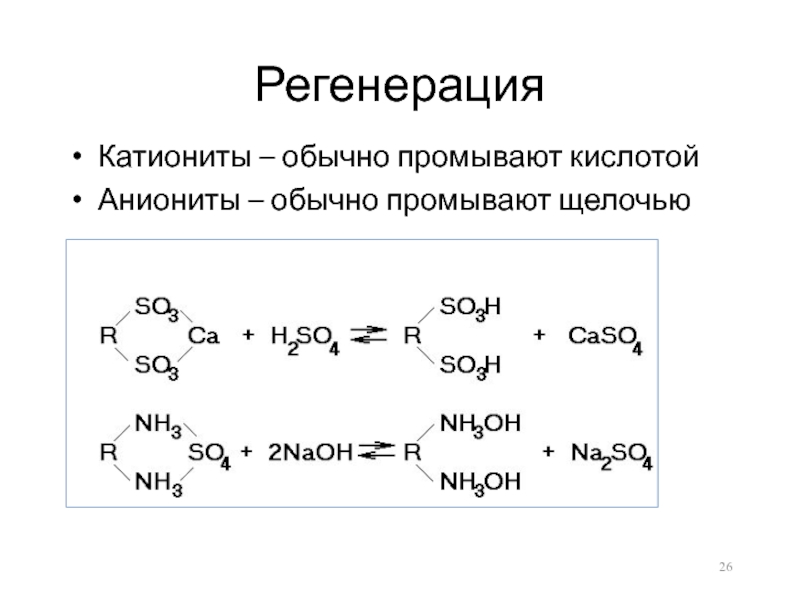
- 26. РегенерацияКатиониты – обычно промывают кислотойАниониты – обычно промывают щелочью
- 27. ПрименениеОчистка сточных водВ хроматографииКак антацидные средстваДля консервирования крови
- 28. ХроматографияФизико-химический метод разделения смеси веществ, основанный на
- 29. Виды хроматографии по механизму действияАдсорбционная – основана
- 30. Хемосорбционная хроматографияОсадочная – образование осадкаАдсорбционно-комплексообразовательная – образование
- 31. Молекулярно-ситевая (гельфильтрация)Позволяет разделить вещества с различной величиной молекул
- 32. По технике проведенияКолоночная хроматография (капиллярная)Тонкослойная бумажная
- 33. Применение хроматографииУстановление аминокислотного состава гидролизатов и первичной
- 34. Скачать презентанцию
План лекцииВиды адсорбцииФакторы, влияющие на скорость адсорбции газов и паровИзотерма адсорбцииУравнение Фрейндлиха. Уравнение ЛенгмюраОсобенности адсорбции из растворовПравило РебиндераПравило Панета-Фаянса-ПесковаХроматография и ее виды
Слайды и текст этой презентации
Слайд 2План лекции
Виды адсорбции
Факторы, влияющие на скорость адсорбции газов и паров
Изотерма
адсорбции
ее видыСлайд 3Немного истории…
Ловиц Т.Е., Шееле – первое учение об адсорбции
Цвет М.С.
– основатель хроматографии
Зелинский Н.Д. – изобретатель противогаза
Дубинин М.М., Шилов Н.А.,
Дерягин В.В., Фрумкин А.Н., Ребиндер П.А. – изучение поверхностно-активных веществ и адсорбцииГиббс, Ленгмюр, Фрейндлих, Брунауэр – разработка теории и практики адсорбции
Слайд 4Поверхность твердого тела
Твердыми телами могут адсорбироваться газы и пары, а
также молекулы и ионы растворенных веществ и растворителей. Твердая поверхность
неоднороднаАктивные центры – участки поверхности твердого тела, на которых наблюдается концентрация избыточной поверхностной энергии
Слайд 5Особенности адсорбции
На активном центре адсорбируются молекулы, как правило, в один
слой (мономолекулярная адсорбция)
Происходят процессы адсорбции и десорбции. При достижении равновесия
устанавливается определенная величина адсорбцииСлайд 6Виды адсорбции
По механизму адсорбционных сил:
Физическая – осуществляется за счет сил
межмолекулярного притяжения (сил Ван-дер-Ваальса). Теплота: 4-40 кДж/моль. Обратима
Химическая – кроме
сил межмолекулярного притяжения имеет место образование химических связей между сорбтивом и сорбентом. Теплота: 40-400 кДж/моль Слайд 8Факторы, влияющие на скорость адсорбции газов и паров
Природа веществ
Смачивание поверхности
Величина
удельной поверхности
Температура
Концентрация и давление пара или газа
Слайд 9Природа веществ
Неполярные адсорбенты хорошо адсорбируют неполярные вещества
Полярные адсорбенты хорошо адсорбируют
полярные вещества
Чем больше величина смачиваемости сорбента веществом, тем лучше оно
будет адсорбироваться на немСлайд 10Величина удельной поверхности
S
Sудель = --------
m
Чем выше величина удельной поверхности, тем
лучше идет адсорбция (активированный уголь, высокодисперсные металлы и их оксиды,
силикагель)S 1 г активированного угля = 500 – 1 000 м2
Слайд 11Температура и давление
Адсорбция – процесс экзотермический; повышение температуры снижает величину
адсорбции
При повышении концентрации, давления пара или газа, величина адсорбции увеличивается
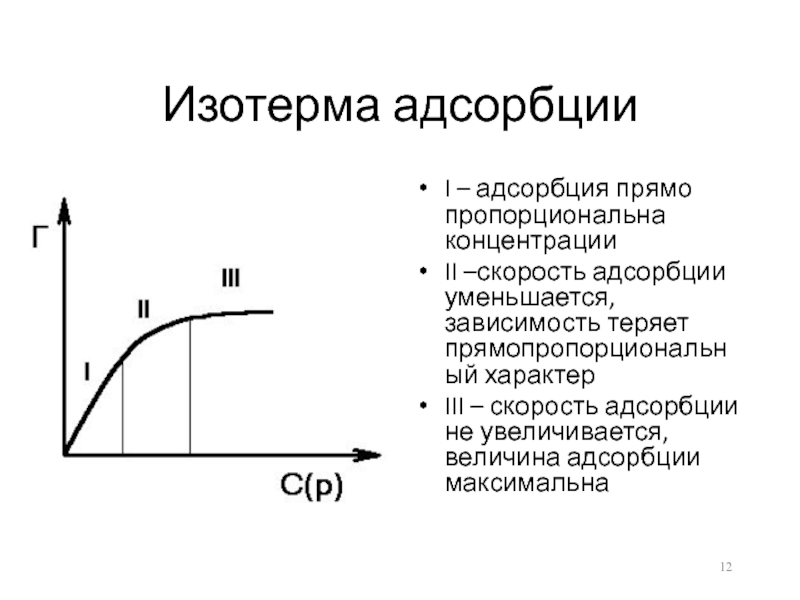
Слайд 12Изотерма адсорбции
I – адсорбция прямо пропорциональна концентрации
II –скорость адсорбции уменьшается,
зависимость теряет прямопропорциональный характер
III – скорость адсорбции не увеличивается, величина
адсорбции максимальнаСлайд 13Уравнение Фрейндлиха
Г = КФ · С n
КФ – константа Фрейндлиха
С
– концентрация растворенного вещества или давление газа
n – константа, характерная
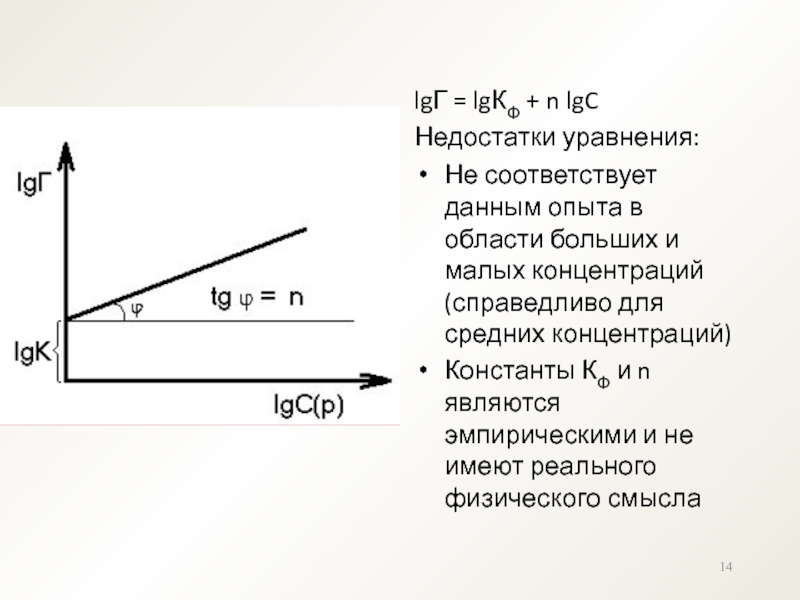
для определенного процесса (0,1 n 0,6)Слайд 14lgГ = lgКФ + n lgC
Недостатки уравнения:
Не соответствует данным
опыта в области больших и малых концентраций (справедливо для средних
концентраций)Константы КФ и n являются эмпирическими и не имеют реального физического смысла
Слайд 15Уравнение Ленгмюра и его анализ
С
Г = Г
· ---------- КЛ – константа Ленгмюра
КЛ
+ С Г – величина адсорбцииГ – предельная адсорбция
При С 0
С
Г = Г · ------- – первый участок
КЛ
При С >> КЛ
Г = Г – третий участок
Промежуточные значения могут быть рассчитаны
Слайд 16Особенности адсорбции из растворов
Зависит от способности к адсорбции растворенного вещества
и растворителя
Чем лучше вещество растворяется, тем хуже оно адсорбируется
Более полно
происходит адсорбция из растворов низкой концентрацииТемпература уменьшает адсорбцию, но если повышение температуры уменьшает растворимость вещества, адсорбция может увеличиваться
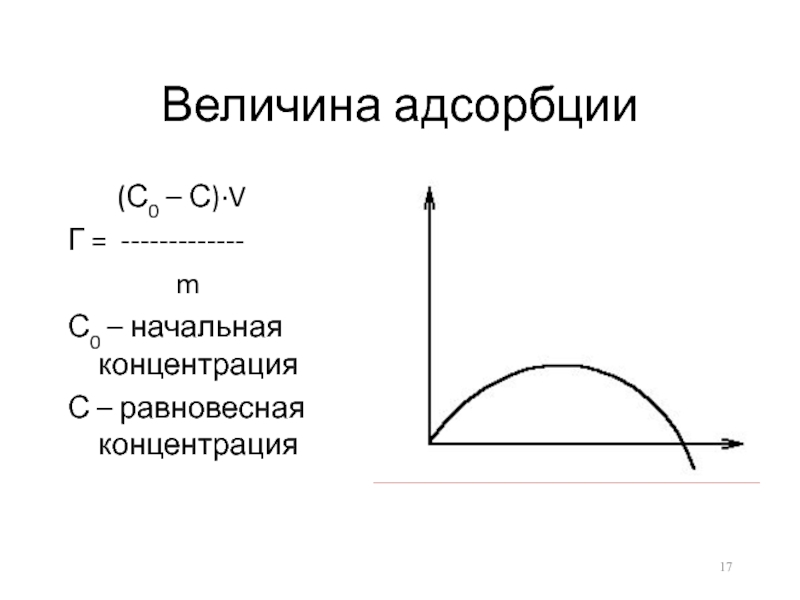
Слайд 17Величина адсорбции
(С0 – С)·V
Г = -------------
m
С0 – начальная концентрация
С – равновесная концентрация
Слайд 18Правило Ребиндера
На полярных адсорбентах лучше адсорбируются полярные вещества из неполярных
растворителей
На неполярных адсорбентах лучше адсорбируются неполярные вещества из полярных растворителей
В
системе полярный растворитель – неполярный адсорбент (вода – уголь) адсорбция ПАВ подчиняется правилу Дюкло-ТраубеПри адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращенное правило Дюкло-Траубе:
С ростом длины углеводородного радикала адсорбция уменьшается
Слайд 19Особенности адсорбции из растворов электролитов
В механизме адсорбции участвуют силы межмолекулярного
притяжения и силы электростатического взаимодействия
Ионы определенного знака адсорбируются на функциональных
группах адсорбента с противоположным знакомСлайд 20Величина заряда иона
Многовалентные ионы адсорбируются лучше одновалентных (кроме Н+)
H+ >
Fe3+ > Al3+ > Ba2+ > Ca2+ > Mg2+ >
NH4+ > K+ > Na+В случае равновалентных ионов лучше адсорбируется тот, который имеет большие размеры – менее гидратирован
По способности к адсорбции ионы располагаются в лиотропные ряды:
Cs+ > Rb+ > NH4 > K+ > Na+ > Li+ – катионов
NO3- > J- > Br- > Cl- > F- – анионов
Слайд 21Правило Панета-Фаянса-Пескова
На твердом адсорбенте адсорбируется тот ион, который входит в
состав адсорбента или имеет с ним общую группу
AgNO3 + KJ
= AgJ + KNO3Избыток AgNO3 – заряд осадка «+»
Избыток KJ – заряд осадка «–»
Избирательная адсорбция ионов имеет большое значение для устойчивости коллоидных растворов
Слайд 22Значение адсорбции для биологических процессов
Все ферментативные реакции начинаются с избирательной
адсорбции субстрата на ферменте
Поражение различных органов токсинами происходит в силу
их избирательной адсорбции (брюшной, сыпной тиф)Избирательность действия лекарств и ядовитых веществ, попадающих в организм, объясняется избирательной адсорбцией
Слайд 23Обменная адсорбция
Вытеснение одного сорбтива другим более сильным сорбтивом
Ионообменная – замена
на адсорбенте одного иона другими ионами, содержащимися в растворе
Аниониты –
ионообменные вещества, обменивающиеся анионами (– NH2, – N(CH3)2, – OH)Катиониты – ионообменные вещества, обменивающиеся катионами (– СООН, – ОН, – SO3H)
Слайд 24Гемосорбция – очистка крови от токсинов и нормализация ее электролитного
состава с помощью сорбентов или ионитов
Лимфосорбция – очистка лимфы от
токсиновСлайд 27Применение
Очистка сточных вод
В хроматографии
Как антацидные средства
Для консервирования крови
Слайд 28Хроматография
Физико-химический метод разделения смеси веществ, основанный на различном распределении компонентов
смеси между двумя фазами:
неподвижной, с большой поверхностью контакта (адсорбент);
подвижным
потоком, проходящим через неподвижную фазу (растворитель)Слайд 29Виды хроматографии
по механизму действия
Адсорбционная – основана на различной способности веществ
к адсорбции
Распределительная – основана на различном распределении вещества в двух
фазахХемосорбционная – в ее основе лежит химический процесс
Слайд 30Хемосорбционная хроматография
Осадочная – образование осадка
Адсорбционно-комплексообразовательная – образование комплексных соединений
Редокс-хроматография –
основана на О-В реакциях
Афинная (биоспецифическая) – использование ферментативных реакций
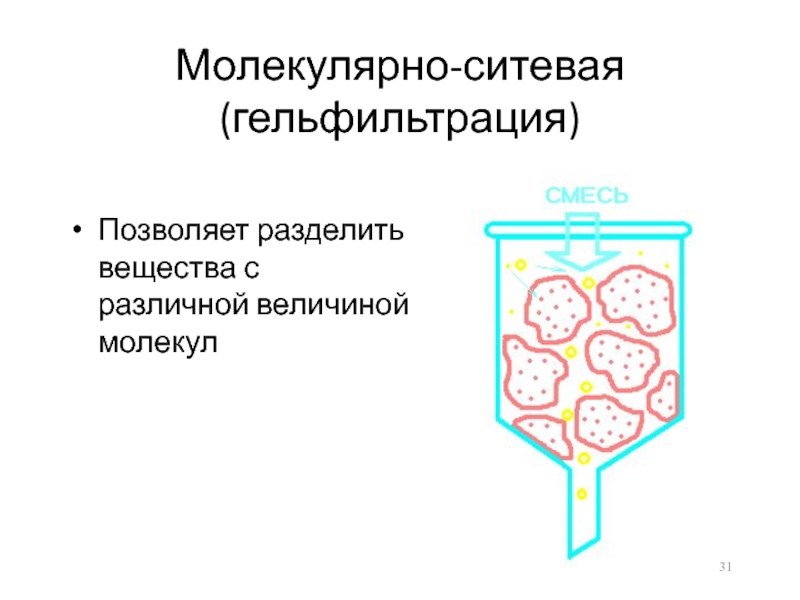
Слайд 31Молекулярно-ситевая (гельфильтрация)
Позволяет разделить вещества с различной величиной молекул
Слайд 33Применение хроматографии
Установление аминокислотного состава гидролизатов и первичной структуры белков
Изучение аминокислотного
состава плазмы и других биологических сред
Количественное определение витаминов, гормонов и
других биологически активных соединенийВыделение различных веществ в чистом виде и их идентификация
Диагностика разнообразных заболеваний
Анализ крови на присутствие алкоголя, наркотиков; допинг-контроль