Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
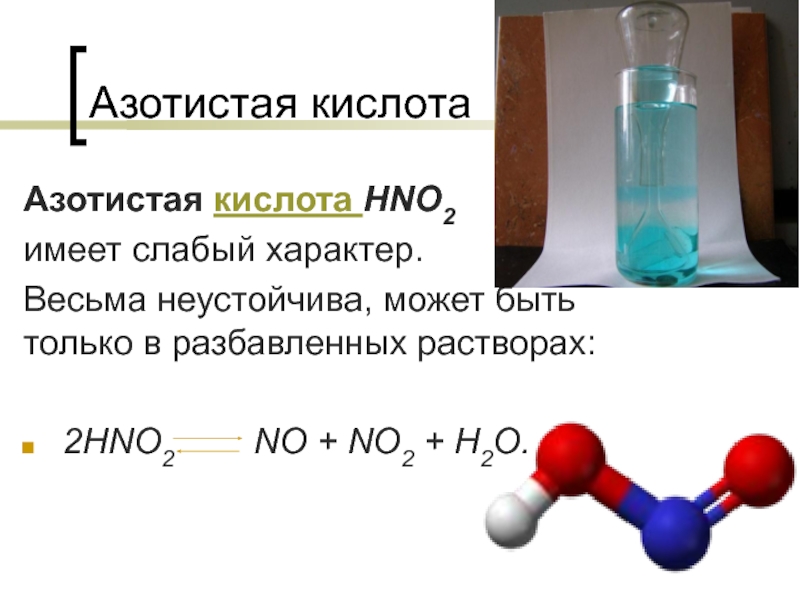
Азотистая кислота
Содержание
- 1. Азотистая кислота
- 2. Атом азота в азотистой кислоте имеет промежуточную
- 3. Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислотыЗапишите уравнение
- 4. Соли азотистой кислоты называются нитритами Нитриты гораздо
- 5. HNO3Состав. Строение. Свойства.HONOO——степень окисления азотавалентность азота+5IVхимическая связьковалентная
- 6. При разложении азотной кислоты выделяется кислород, поэтому скипидар вспыхивает.
- 7. Азотная кислота (HNO3) Классификацияналичию кислорода:основности:растворимости в воде:летучести:степени электролитической диссоциации:кислородсодержащаяодноосновнаярастворимаялетучаясильная Азотная кислота по:
- 8. Получение азотной кислоты в промышленностиNH3
- 9. В лаборатории азотную кислоту получают действием концентрированной
- 10. Химические свойства азотной кислоты1. Типичные свойства кислот2.
- 11. Химические свойства азотной кислотыАзотная кислота проявляет все
- 12. 2HNO3 + CuO = Cu(NO3)2 + H2O16HNO3
- 13. Взаимодействие азотной кислоты с металламиКак реагируют металлы
- 14. Найти закономерность при взаимодействии азотной кислоты с металлами:
- 15. Единственная общая закономерность при взаимодействии азотной кислоты
- 16. Допишите схемы реакций:Рассмотрите превращения в свете ОВР1)
- 17. Взаимодействие азотной кислоты с неметаллами
- 18. Применение азотной кислоты154623Производство азотных и комплексных удобрений.Производство
- 19. Соли азотной кислотыКак называются соли азотной кислоты?
- 20. Нитрат калия (калиевая селитра)Бесцветные кристаллы Значительно менее
- 21. Кристаллическое вещество белого цвета. Температура плавления 169,6
- 22. При нагревании нитраты разлагаются тем полнее, чем
- 23. 1. Степень окисления азота в азотной кислоте
- 24. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Азотистая кислота
Азотистая кислота HNO2
имеет слабый характер.
Весьма неустойчива,
может быть только в разбавленных растворах:
+ NO2 + H2O.Слайд 2Атом азота в азотистой кислоте имеет промежуточную степень окисления +3
в связи с этим он может быть и окислителем, и
проявлять восстановительные свойства:HNO2 + HI = I2 + NO + H2O,
HNO2 + H2O2 = HNO3 + H2O,
KNO2 + KMnO4 + H2SO4 = KNO3 +
K2SO4 + MnSO4 + H2O.
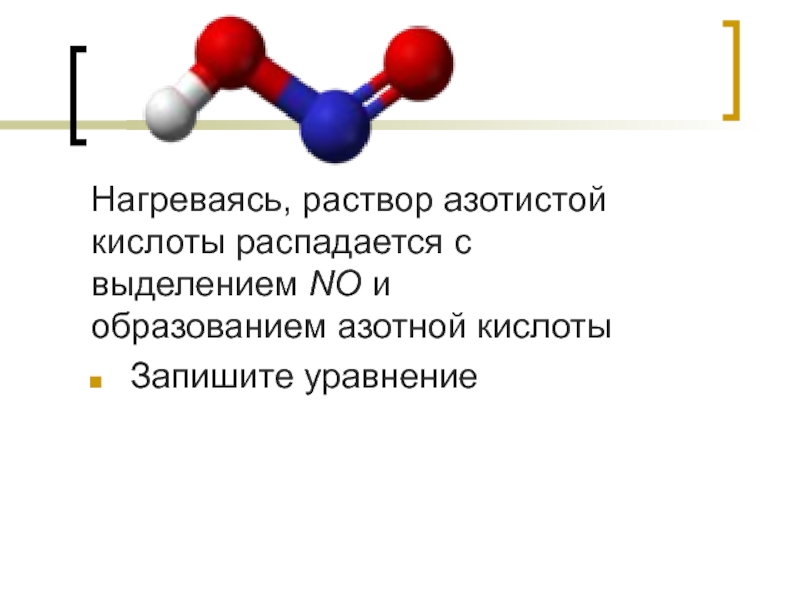
Слайд 3Нагреваясь, раствор азотистой кислоты распадается с выделением NO и образованием азотной кислоты
Запишите уравнение
Слайд 4Соли азотистой кислоты называются нитритами
Нитриты гораздо более устойчивы, чем
HNO2, все они токсичны. Представляют собой кристаллические вещества, хорошо растворимые
в воде (труднее других - AgNО2)Свойства .
1) Как и HNО2, нитриты обладают окислительно-восстановительной двойственностью:
KNО2 + Н2О2 = KNО3 + Н2O
3KNО2 + 2КМпO4 + Н2O = 3KNО3 + 2MnО2↓ + 2КОН
2KNО2 + 2KI + 2H2SO4 = 2NO + I2 + 2K2SO4 + 2Н2O
2) Нитрит аммония разлагается при нагревании: NH4NО2 = N2↑ + 2Н2O
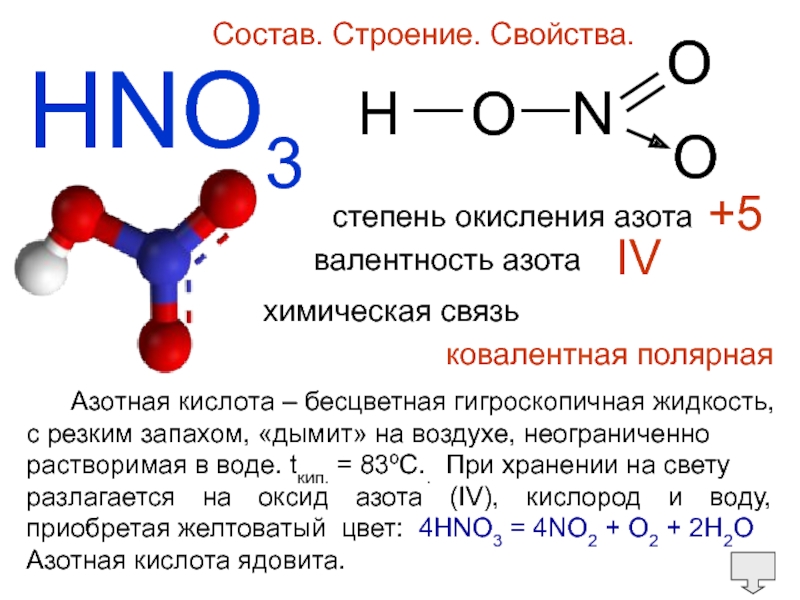
Слайд 5HNO3
Состав. Строение. Свойства.
H
O
N
O
O
—
—
степень окисления азота
валентность азота
+5
IV
химическая связь
ковалентная полярная
Азотная кислота – бесцветная гигроскопичная жидкость,
c резким запахом, «дымит» на
воздухе, неограниченно растворимая в воде. tкип. = 83ºC.. При хранении на свету
разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет: 4HNO3 = 4NO2 + O2 + 2H2O
Азотная кислота ядовита.
Слайд 7Азотная кислота (HNO3)
Классификация
наличию кислорода:
основности:
растворимости в воде:
летучести:
степени электролитической
диссоциации:
кислородсодержащая
одноосновная
растворимая
летучая
сильная
Азотная кислота по:
Слайд 8Получение азотной кислоты в промышленности
NH3 NO
NO2 HNO3
4NH3+ 5O2 = 4NO + 6H2O
2NO+O2 =
2NO24NO2 + 2H2O + O2 = 4HNO3
1. Контактное окисление аммиака до
оксида азота (II):
2. Окисление оксида азота (II) в оксид
азота (IV):
3. Адсорбция (поглощение) оксида
азота (IV) водой при избытке кислорода
Слайд 9В лаборатории азотную кислоту получают действием концентрированной серной кислоты на
нитраты при слабом нагревании.
Составьте уравнение реакции получения азотной кислоты.
NaNO3 +
H2SO4 = NaHSO4 + HNO3Слайд 10Химические свойства азотной кислоты
1. Типичные свойства кислот
2. Взаимодействие азотной кислоты
с металлами
3. Взаимодействие азотной кислоты с неметаллами
Слайд 11Химические свойства азотной кислоты
Азотная кислота проявляет все типичные свойства кислот.
Перечислите
их:
Составьте уравнения реакций азотной кислоты:
1
3
2
с оксидом меди (II), оксидом
алюминия;c гидроксидом натрия, гидроксидом цинка;
c карбонатом аммония, силикатом натрия.
Дайте названия полученным веществам. Определите тип реакции.
3
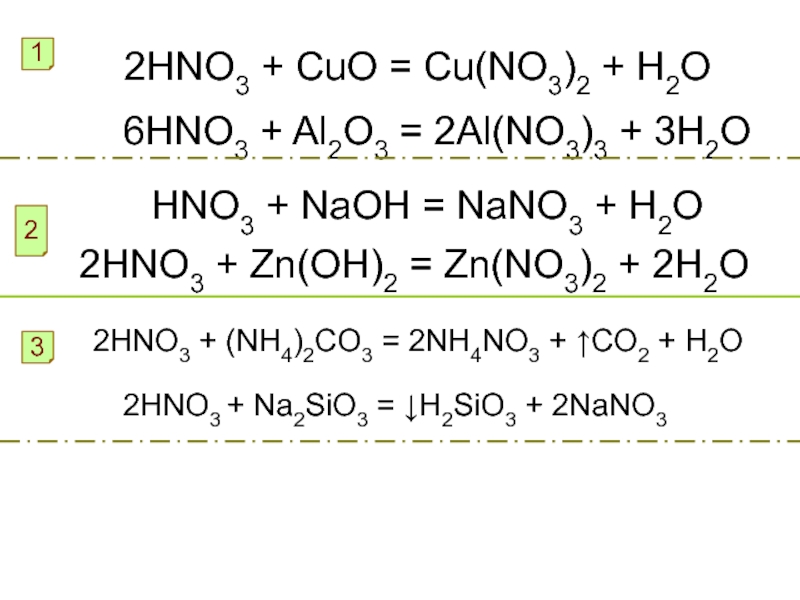
Слайд 122HNO3 + CuO = Cu(NO3)2 + H2O
1
6HNO3 + Al2O3 =
2Al(NO3)3 + 3H2O
HNO3 + NaOH = NaNO3 + H2O
2
2HNO3 +
Zn(OH)2 = Zn(NO3)2 + 2H2O3
2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O
2HNO3 + Na2SiO3 = ↓H2SiO3 + 2NaNO3
Слайд 13Взаимодействие азотной кислоты с металлами
Как реагируют металлы с растворами кислот?
Металлы,
стоящие в ряду активности до водорода, вытесняют
его из кислот. Металлы,
стоящие после водорода из кислот егоне вытесняют, т.е. не взаимодействуют с кислотами, не
растворяются в них.
Особенности взаимодействия азотной кислоты с металлами:
1. Ни один металл никогда не выделяет из азотной кислоты
водород. Выделяются разнообразные соединения азота:
N+4O2, N+2O, N2+1O, N20, N–3H3 (NH4NO3)
2. С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.
3. Азотная кислота не взаимодействует с Au, Pt
4. Концентрированная азотная кислота пассивирует металлы:
Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной
оксидной пленки). При нагревании и при разбавлении азотной кислоты данные металлы в ней растворяются.
N–3H4+
N20
N2+1O
N+2O
N+4O2
концентрация кислоты
активность металлов
Слайд 15Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем
более разбавленная кислота и чем активнее металл, тем глубже восстанавливается
азот:Увеличение конц. кислоты
Увеличение
активности
металла
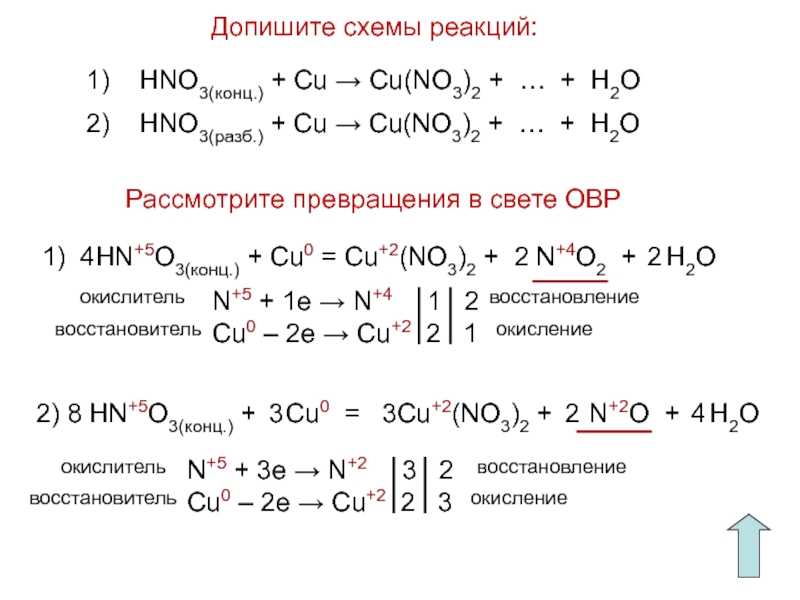
Слайд 16Допишите схемы реакций:
Рассмотрите превращения в свете ОВР
1) HNO3(конц.) +
Cu → Cu(NO3)2 + … + H2O
2) HNO3(разб.) +
Cu → Cu(NO3)2 + … + H2O 1) HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + N+4O2 + H2O
2
2
N+5 + 1e → N+4 1 2
Cu0 – 2e → Cu+2 2 1
2) HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + N+2O + H2O
3
3
4
2
8
N+5 + 3e → N+2 3 2
Cu0 – 2e → Cu+2 2 3
восстановление
окисление
восстановитель
окислитель
4
восстановление
окисление
окислитель
восстановитель
Слайд 17Взаимодействие азотной кислоты с неметаллами
Окисляет неметаллы до соответствующих кислот.
Концентрированная (более
60%) азотная кислота восстанавливается до NO2 , а если концентрация кислоты (15 – 20%), то до NO.HNO3 + С → СO2 + H2O + NO2
N+5 + 1e → N+4 1 4
С0 – 4e → С+4 4 1
4
4
2
HNO3 + P → H3PO4 + NO2 + H2O
N+5 + 1e → N+4 1 5
P0 – 5e → P+5 5 1
5
2
5
HNO3 + P + H2O → H3PO4 + NO
N+5 + 3e → N+2 3 5
P0 – 5e → P+5 5 3
3
5
3
5
Азотная кислота как сильный окислитель
Расставьте в схемах коэффициенты методом электронного баланса.
HNO3 (за счет N+5) – окислитель, пр. восстановления
C – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
HNO3 (за счет N+5) – окислитель, пр. восстановления
P – восстановитель, процесс окисления
Слайд 18Применение азотной кислоты
1
5
4
6
2
3
Производство азотных и комплексных
удобрений.
Производство взрывчатых веществ
Производство красителей
Производство
лекарств
Производство пленок,
нитролаков, нитроэмалей
Производство
искусственных волокон
7
Как компонент нитрующей
смеси, для траления
металлов в
металлургииСлайд 19Соли азотной кислоты
Как называются соли азотной кислоты?
нитраты
Нитраты K, Na, NH4+
называют селитрами Составьте формулы перечисленных солей.
KNO3
NaNO3
NH4NO3
Нитраты – белые кристаллические
вещества. Сильные электролиты, в
растворах полностью диссоциируют
на ионы. Вступают в реакции обмена.
Каким способом можно определить нитрат-ион в растворе?
К соли (содержащей нитрат-ион) добавляют серную кислоту и медь. Смесь слегка подогревают. Выделение бурого газа (NO2) указывает на наличие нитрат-иона.
Слайд 20Нитрат калия (калиевая селитра)
Бесцветные кристаллы Значительно
менее гигроскопична по сравнению
с
натриевой, поэтому широко применя-ется в пиротехнике как окислитель.
При нагревании выше
334,5ºС плавится, выше этой температуры разлагается с выделением кислорода.
Применяется как удобрение; в
стекольной, металлообрабатываю-щей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.
Нитрат натрия
Слайд 21Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве
выше этой температуры начинается постепенное разложение вещества, а при температуре
210°С происходит полное разложение.Нитрат аммония
Слайд 22При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом
ряду напряжений стоит металл, образующий соль.
Li K Ba Ca Na
Mg Al Mn Zn Cr Fe Co Sn Pb Cu Ag Hg Auнитрит + О2
оксид металла + NO2 + O2
Ме + NO2 + O2
Составьте уравнения реакций разложения нитрата натрия, нитрата свинца, нитрата серебра.
2NaNO3 = 2NaNO2 + O2
2Pb(NO3)2= 2PbO + 4NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
Слайд 231. Степень окисления азота в азотной кислоте равна:
А)
+5; Б) +4; В) -3.
А
2. При
взаимодействии с какими веществами азотная кислота проявляетособые свойства, отличающие её от других кислот:
А) основными оксидами; Б) металлами; В) основаниями.
Б
3. В окислительно-восстановительной реакции азотная кислота может
участвовать в качестве:
А) окислителя; Б) восстановителя; В) окислителя и восстановителя.
А
4. Какое из данных соединений азота называют чилийской селитрой:
А) нитрат калия; Б) нитрат кальция; В) нитрат натрия;
В
5. Запишите уравнение взаимодействия меди с концентрированной
азотной кислотой . Коэффициент перед формулой кислоты равен:
А) 2; Б) 4; В) 1.
Б
6. Какое из перечисленных веществ не реагирует с разбавленной
азотной кислотой:
А) медь; Б) гидроксид натрия; В) бромид натрия.
В
7. Азотную кислоту получают в три стадии, окисляя атом азота по
следующей схеме:
А) N–3 →N+2 →N+4 → N+5
Б) N–3 →N0 →N+4 → N+5 В) N0 →N+2 →N+4 → N+5
А