Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогенпроизводные алканов
Содержание
- 1. Галогенпроизводные алканов
- 2. 3. Присоединение галогенводородов и галогенов к олефинам
- 3. 6. Взаимодействие карбонильных соединений с галогенидами фосфора
- 4. Замещение протекает по двум механизмам:Мономолекулярное нуклеофильное замещение
- 5. Факторы, благоприятствующие протеканию нуклеофильного замещения по механизму
- 6. 3. Природа нуклеофильного реагентаСкорость реакций SN1 не
- 7. Факторы, благоприятствующие протеканию нуклеофильного замещения по механизму
- 8. б) Нуклеофильность группы увеличивается сверху вниз:H2S >
- 9. Гексаметилтриамидофосфат ГМФТАДиметилсульфоксидПример:5. Стереохимический результат реакции – обращение конфигурации (инверсия)(R)-2 хлорбутан(S)-2 бутанол
- 10. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1Галогенпроизводные алканов
Методы получения
1. Галогенирование углеводородов (реакция металепсии Дюма)
Цепная свободнорадикальная реакция
2.
Взаимодействие спиртов с галогенводородами
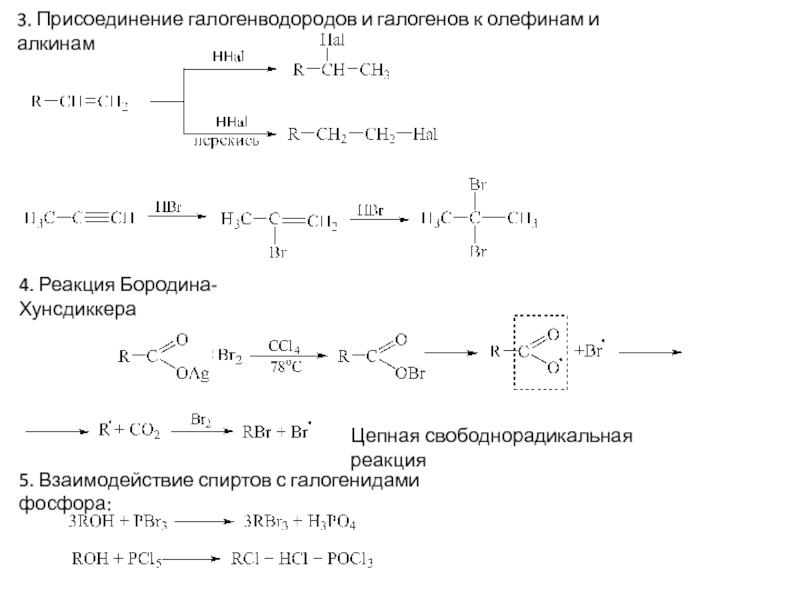
Слайд 23. Присоединение галогенводородов и галогенов к олефинам и алкинам
4. Реакция
Бородина-Хунсдиккера
5. Взаимодействие спиртов с галогенидами фосфора:
Цепная свободнорадикальная реакция
Слайд 36. Взаимодействие карбонильных соединений с галогенидами фосфора
и
хлористым тионилом:
2,2 - дихлорпропан
Химические свойства
Галогенпроизводные углеводородов – мощные алкилирующие агенты
Сульфиды
Тиолы
(меркаптаны)Нитрилы
Сложные эфиры
Нитросоединения
Спирты
Простые эфиры
Азиды
Слайд 4Замещение протекает по двум механизмам:
Мономолекулярное нуклеофильное замещение SN1 (формально мономолекулярное)
=
k1[RHal]
Скорость пропорциональна только концентрации субстрата и подчиняется кинетическому уравнению первого
порядка.2. Бимолекулярное нуклеофильное замещение SN2
= k1[RHal][Nu-]
Скорость подчиняется кинетическому уравнению второго порядка.
Слайд 5Факторы, благоприятствующие протеканию нуклеофильного замещения по механизму SN1
Стабильность карбкатиона
Реакционная способность галогенпроизводных возрастает в том же порядке, что и
устойчивость карбкатионов, образующихся в скоростьлимитирующих стадиях2. Природа уходящей группы
В ряду связей C–F, C–Cl, C–Br, C–J увеличивается длина связи и поляризуемость, снижается ее прочность. HJ – самая сильная кислота, соответствует лучшей уходящей группе J-.
Соли серебра катализируют реакции SN1
Слайд 63. Природа нуклеофильного реагента
Скорость реакций SN1 не зависит от природы
нуклеофильного реагента и его концентрации.
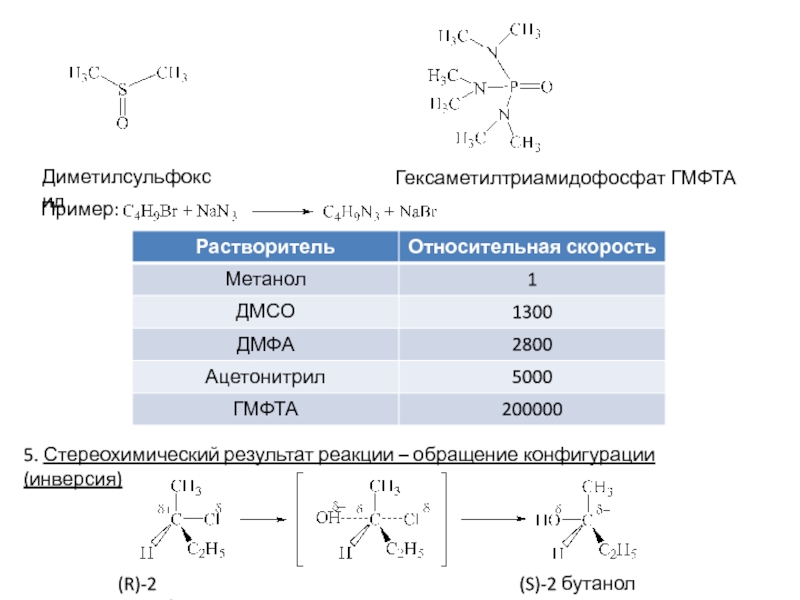
4. Природа растворителя
Протеканию реакций способствуют полярные
протонные растворители с высокой ионизирующей способностью. Растворитель сольватирует галогенид-ион за счет водородных связей (специфическая сольватация)5. Стереохимический результат реакции - рацемат
Карбкатион плоский, атака нуклеофилом равновероятная с обеих сторон
Образующаяся эквимолярная смесь оптических антиподов, не обладающая оптической активностью (рацемат)
Слайд 7Факторы, благоприятствующие протеканию нуклеофильного замещения по механизму SN2
Стабильность карбкатиона
Первичный R+ > Вторичный R+ >> Третичный R+
Относительная скорость
30 1 0,03 0Низкая реакционная способность третичных галогенидов объясняется пространственными препятствиями, создаваемыми алкильными группами при
a-углероде, для атаки нуклеофилом с тыльной стороны.
2. Природа уходящей группы. Аналогично SN1
J- > Br- > Cl- > F-
3. Природа нуклеофильного реагента
Анионы значительно более сильные нуклеофилы, чем сопряженные им кислоты
Для протонных растворителей:
а) Нуклеофильность реагентов в одном периоде совпадает с рядом основности, т.е. убывает слева направо в периоде
NH2- > OH- > F-
NH3 > H2O
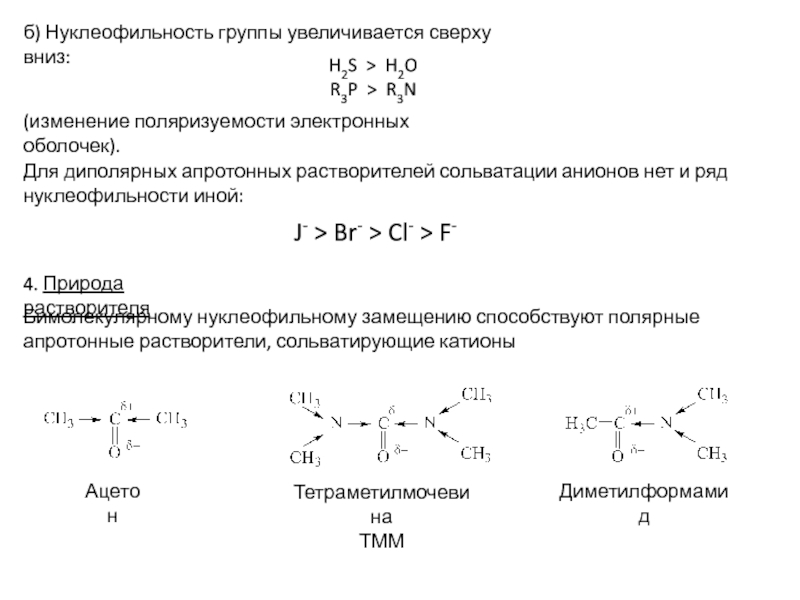
Слайд 8б) Нуклеофильность группы увеличивается сверху вниз:
H2S > H2O
R3P > R3N
Для
диполярных апротонных растворителей сольватации анионов нет и ряд нуклеофильности иной:
(изменение
поляризуемости электронных оболочек).J- > Br- > Cl- > F-
4. Природа растворителя
Бимолекулярному нуклеофильному замещению способствуют полярные апротонные растворители, сольватирующие катионы
Тетраметилмочевина
ТММ
Ацетон
Диметилформамид


![Галогенпроизводные алканов Замещение протекает по двум механизмам:Мономолекулярное нуклеофильное замещение SN1 (формально мономолекулярное)= k1[RHal]Скорость Замещение протекает по двум механизмам:Мономолекулярное нуклеофильное замещение SN1 (формально мономолекулярное)= k1[RHal]Скорость пропорциональна только концентрации субстрата и подчиняется](/img/thumbs/f0a9f4f811c716318b3beac8a41c62ac-800x.jpg)