Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
Содержание
- 1. ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
- 2. Актуальность исследованияДиагностика бычьего аденовируса затруднена из-за
- 3. Учитывая широкую распространенность респираторных
- 4. Цель диссертации: получение штаммов
- 5. Материалы и методы исследованияВ работе использованы штаммы
- 6. Трансформация клеток E.coli.Определение нуклеотидной последовательности
- 7. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Дизайн
- 8. Рис. 2 - Схема
- 9. Получение генетической конструкции на
- 10. Рис. 3 - Электрофорез продуктов
- 11. Трансформация генетической конструкции и получение
- 12. Рис. 4 - Электрофорез продуктов ПЦР
- 13. Рис. 5 - ПААГ электрофорез
- 14. Выделение и очистка рекомбинантного гексона бычьего
- 15. Как следует из приведенных данных,
- 16. Рис. 6 - ПААГ электрофорез
- 17. В результате отработки параметров
- 18. Качественная идентификация гексона бычьего аденовируса методом
- 19. Таким образом, в результате
- 20. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ПОЛУЧЕНИЕ РЕКОМБИНАНТНОГО ГЕКСОНА АДЕНОВИРУСА 3 ТИПА
Вишенина Диана Вячеславовна
Научный руководитель:
Мукантаев Канатбек Найзабекович
Слайд 2
Актуальность исследования
Диагностика бычьего аденовируса затруднена из-за большого количества симптомов. Для
обнаружения вируса применяют различные методы, такие как выделение вируса, гибридизация
in situ, иммуноферментный анализ, иммунофлюоресценция, рестрикционный анализ и ПЦР. Однако, вышеперечисленные методы затратные по времени и требуют дорогостоящего оборудования и системы культуры ткани. В связи с этим, получение рекомбинантных антигенов вируса имеющих диагностическое значение является весьма актуальным.Слайд 3
Учитывая широкую распространенность респираторных и желудочно-кишечных болезней молодняка сельскохозяйственных животных
в Республике Казахстан, разработка современных экспресс тестов для выявления аденовирусной
инфекции, основанных на рекомбинантных антигенах вируса и моноклональных антителах является весьма актуальной для нашей страны.В диагностическом плане наибольший интерес представляет капсидный белок аденовируса гексон. При этом гексон является группоспецифическим белком и индуцирует образование группоспецифических антител.
Слайд 4
Цель диссертации: получение штаммов E.coli, продуцирующих рекомбинантный гексон бычьего аденовируса
3-го типа.
Для достижения цели научной работы были поставлены следующие
задачи:1. Дизайн генетической конструкции, несущей ген гексона бычьего аденовируса 3-го типа
2. Синтез гена гексона бычьего аденовируса и клонирование гена в экспрессионные плазмиды рЕТ32 и рЕТ28.
3. Трансформация компетентных клеток микроорганизмов полученными генетическими конструкциями.
4. Выделения и очистка рекомбинантного гексона бычьего аденовируса 3-го типа.
Новизна работы заключается в получении впервые в Казахстане рекомбинантного гексона бычьего аденовируса 3-го типа и разработке на его основе экспресс-теста для серологической диагностики болезней молодняка.
Теоретическая и практическая значимость. На основе полученных штаммов-продуцентов рекомбинантного гексона будут разработаны серологические экспресс-тесты для диагностики аденовирусных инфекций у крупного рогатого скота.
Слайд 5Материалы и методы исследования
В работе использованы штаммы Е. coli DH5cc,
BL21(DE3), плазмидный вектор pGEM-TEasy (Promega, USA), pET28, pET32. Клетки E.
coli выращивали в LB среде.Для синтеза гена гексона аденовируса крупного рогатого скота 3-го типа использованы олигонулеотиды синтезированные в условиях de novo.
Выделение и очистка плазмидной ДНК из штамма E.coli методом щелочного лизиса.
Фракционирование фрагментов ДНК методом электрофореза в агарозном геле.
Разделение фрагментов ДНК проводили в агарозном геле. Фрагменты выделяли из геля методом электроэлюции.
Лигирование фрагментов ДНК проводили с помощью фермента ДНК-лигазы фага Т4.
Рестрикцию плазмидной ДНК проводили с использованием эндонуклеаз рестрикции NdeI, XhoI и BamHI.
Слайд 6
Трансформация клеток E.coli.
Определение нуклеотидной последовательности ДНК по методу Сэнгера.
Трансформация компетентных
клеток плазмидными векторами рЕТ-28 и рЕТ-32 со вставками генов и
экспрессия белка.Лизирование клеток осуществляли с использованием ультразвукового дезинтегратора.
Очистку белка осуществляли металлохелатной хроматографией.
Электрофоретическое разделение белков в полиакриламидном геле.
Постановка иммуноблотинга.
Тандемная масс-спектрометрия для качественной идентификация белка гексона и сравнения данных с базой данных SwissProt по программе Mascot.
Слайд 7 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Дизайн и синтез генетической
конструкции, несущей ген фрагмента N-терминальной части гексона бычьего аденовируса
В
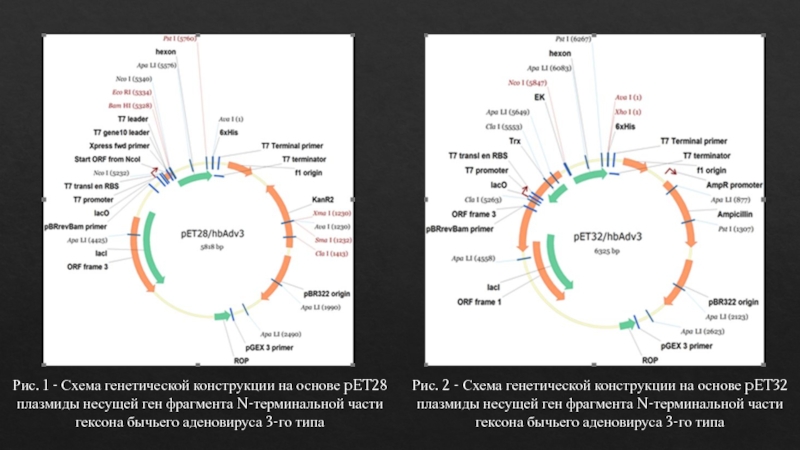
результате проведенного дизайна, на основе pET28 и pET32 плазмид, были разработаны две генетические конструкции, несущих ген фрагмента N-терминальной части гексона аденовируса крупного рогатого скота 3-го типа.Экспрессионный регион плазмидного вектора pET28 вместе со встроенным геном включает гены 6His-Tag, тромбиновый сайт, ген фрагмента N-терминальной части гексона вируса и 6His-Tag. Прогнозируемая молекулярная масса рекомбинантного белка экспрессируемая плазмидой составляет 24 кДа.
В отличие от вектора pET28, экспрессионный регион плазмидного вектора pET32 включает гены тиоридоксинового белка, His-Tag, S-Tag, тромбина и энтерокиназы, His и S меток после выделения и очистки белка, гена фрагмента гексона и 6His-Tag.
Слайд 8
Рис. 2 - Схема генетической конструкции на основе pET32 плазмиды
несущей ген фрагмента N-терминальной части гексона бычьего аденовируса 3-го типа
Рис.
1 - Схема генетической конструкции на основе pET28 плазмиды несущей ген фрагмента N-терминальной части гексона бычьего аденовируса 3-го типаСлайд 9
Получение генетической конструкции на основе вектора pET28 и рЕТ32, несущей
ген фрагмента N-терминальной части гексона бычьего аденовируса
На основе отобранной аминокислотной
последовательности фрагмента N-терминальной части гексона аденовируса крупного рогатого скота получена нуклеотидная последовательность, оптимизированная для экспрессии в кишечной палочке.К полученному гену фрагмента N-терминальной части гексона аденовируса крупного рогатого скота со стороны 3’конца добавлена последовательность гексогистидиновой метки за которой следуют сайты для Xho и HindIII рестриктаз. Со стороны 5’-конца достроены сайты NcoI, EcorI и BamHI рестриктаз.
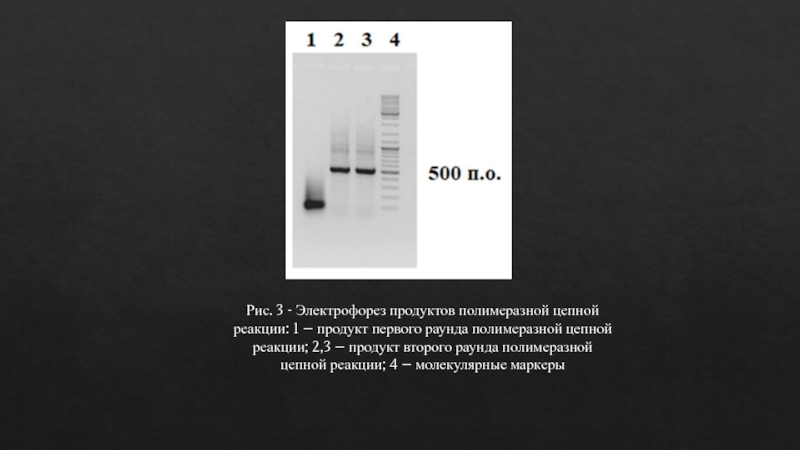
Синтез гена проводили методом двух раундовой полимеразной цепной реакцией. Молекулярная масса полученного продукта составляет 500 пар оснований, что соответствует прогнозируемой длине гена.
Слайд 10
Рис. 3 - Электрофорез продуктов полимеразной цепной реакции: 1 –
продукт первого раунда полимеразной цепной реакции; 2,3 – продукт второго
раунда полимеразной цепной реакции; 4 – молекулярные маркерыСлайд 11
Трансформация генетической конструкции и получение стабильных штаммов микроорганизмов, продуцентов рекомбинантного
гена фрагмента N-терминальной части гексона аденовируса.
Полученный ген фрагмента N-терминальной части
гексона бычьего аденовируса 3-го типа по сайтам рестрикции BamHI и HindIII клонирован в экспрессионную плазмиду pET28. По сайтам рестрикции NcoI и XhoI полученный ген клонирован в экспрессионную плазмиду pET32. Полученные конструкции трансформированы методом электропорации в экспрессионные штаммы E.coli BL21 и высевались на среду LB с содержанием антибиотика канамица для pET28 вектора и ампицилина для pET32 вектора.
Колонии клеток скринировались на наличие экспрессионных векторов, несущих ген фрагмента гексона бычьего аденовируса 3-го типа.
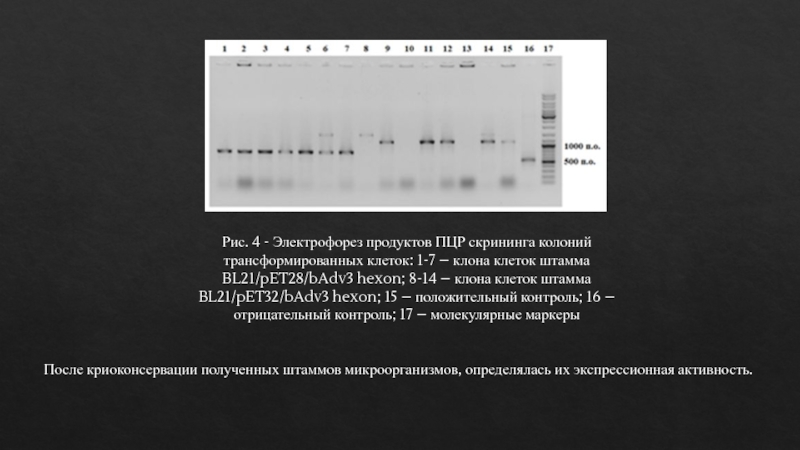
Результаты скрининга показали высокую эффективность трансформации. До 80% клонов несли плазмиды со вставками гена фрагмента гексона бычьего аденовируса 3-го типа.
Слайд 12
Рис. 4 - Электрофорез продуктов ПЦР скрининга колоний
трансформированных клеток:
1-7 – клона клеток штамма BL21/pET28/bAdv3 hexon; 8-14 – клона
клеток штамма BL21/pET32/bAdv3 hexon; 15 – положительный контроль; 16 – отрицательный контроль; 17 – молекулярные маркерыПосле криоконсервации полученных штаммов микроорганизмов, определялась их экспрессионная активность.
Слайд 13
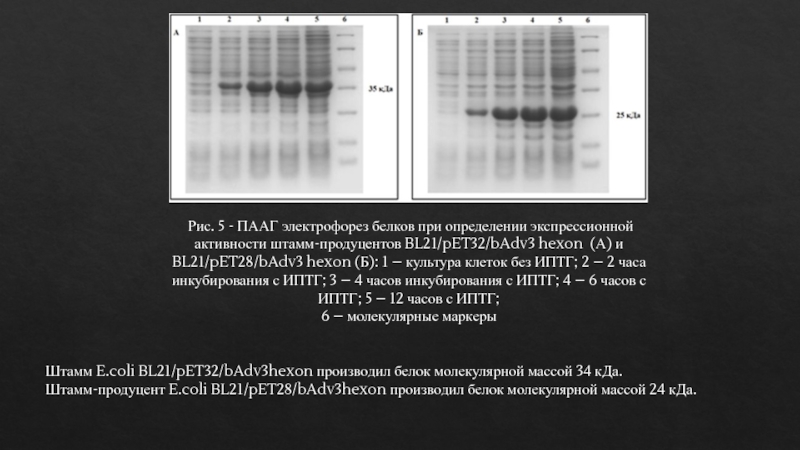
Рис. 5 - ПААГ электрофорез белков при определении экспрессионной
активности штамм-продуцентов BL21/pET32/bAdv3 hexon (А) и BL21/pET28/bAdv3 hexon (Б): 1
– культура клеток без ИПТГ; 2 – 2 часа инкубирования с ИПТГ; 3 – 4 часов инкубирования с ИПТГ; 4 – 6 часов с ИПТГ; 5 – 12 часов с ИПТГ;6 – молекулярные маркеры
Штамм E.coli BL21/pET32/bAdv3hexon производил белок молекулярной массой 34 кДа.
Штамм-продуцент E.coli BL21/pET28/bAdv3hexon производил белок молекулярной массой 24 кДа.
Слайд 14
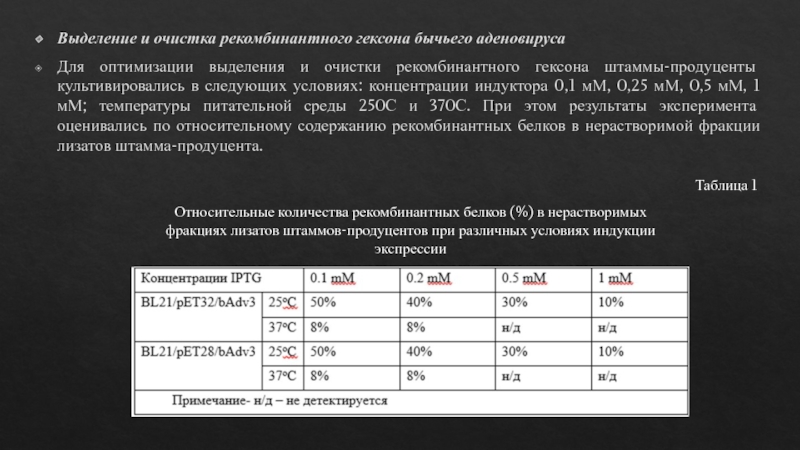
Выделение и очистка рекомбинантного гексона бычьего аденовируса
Для оптимизации выделения и
очистки рекомбинантного гексона штаммы-продуценты культивировались в следующих условиях: концентрации индуктора
0,1 мМ, 0,25 мМ, 0,5 мМ, 1 мМ; температуры питательной среды 250С и 370С. При этом результаты эксперимента оценивались по относительному содержанию рекомбинантных белков в нерастворимой фракции лизатов штамма-продуцента.Относительные количества рекомбинантных белков (%) в нерастворимых фракциях лизатов штаммов-продуцентов при различных условиях индукции экспрессии
Таблица 1
Слайд 15
Как следует из приведенных данных, для всех выбранных для дальнейшей
работы штаммов-продуцентов максимальная продукция рекомбинантных белков в растворимой фракции отмечена
при следующих условиях культивирования: концентрация индуктора 0,2 мМ, температура культивирования после индукции экспрессии 250С.В следствии того, что рекомбинантный белок экспрессировался в тельца включения, важным параметром очистки является оптимальная концентрация мочевины в денатурирующем буфере. При определении оптимального денатурирующего буфера использовались различные концентрации мочевины. Из рисунка видно, что наиболее эффективным является 8 М мочевина.
Слайд 16
Рис. 6 - ПААГ электрофорез белков после денатурации мочевиной: 1
–осадок после разрушения клеток; 2 – над осадочная жидкость после
разрушения клеток; 3 – 1М мочевина; 2 - 4М мочевина; 5 – 8М мочевина; 6 – 2 М мочевина; 7 – молекулярные маркерыСлайд 17
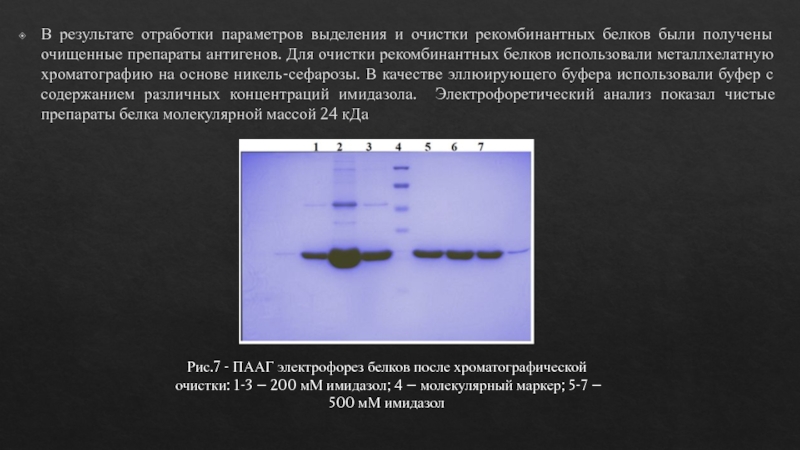
В результате отработки параметров выделения и очистки рекомбинантных белков были
получены очищенные препараты антигенов. Для очистки рекомбинантных белков использовали металлхелатную
хроматографию на основе никель-сефарозы. В качестве эллюирующего буфера использовали буфер с содержанием различных концентраций имидазола. Электрофоретический анализ показал чистые препараты белка молекулярной массой 24 кДаРис.7 - ПААГ электрофорез белков после хроматографической очистки: 1-3 – 200 мМ имидазол; 4 – молекулярный маркер; 5-7 – 500 мМ имидазол
Слайд 18
Качественная идентификация гексона бычьего аденовируса методом масс-спектрометрии.
В результате программой Mascot
были представлены 43 наиболее вероятных белков, соответствующие полученным масс-спектрам, из
которых наибольший скор (Score 2033) соответствовал только одному гексоновому белку рода Mastadenovirus семейства Adenoviridae, что ещё раз подтверждает, что был получен именно гексон бычьего аденовируса.Слайд 19
Таким образом, в результате диссертационной работы:
1. Проведен дизайн генетических конструкций
на основе pET28 и pET32 плазмид, несущих ген фрагмента N-терминальной
части гексона аденовируса крупного рогатого скота 3-го типа.2. Методом двух раундовой полимеразной цепной реакцией синтезирован ген с молекулярной массой 500 пар оснований, что соответствует прогнозируемой длине гена.
3. Проведена трансформация компетентных клеток экспрессионный штамм E.coli BL21 полученными генетическими конструкциями. Скрининг полученных колоний показал высокую эффективность трансформации составляющая 80%.
4. Выделен и очищен рекомбинантный гексон бычьего аденовируса 3 типа. Электрофоретический анализ показал чистые препараты белка молекулярной массой 24 и 34 кДа.