Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Потенциометрия. Использование в диагностике заболеваний и охране окружающей среды
Содержание
- 1. Потенциометрия. Использование в диагностике заболеваний и охране окружающей среды
- 2. ПОТЕНЦИОМЕТРИЯ − …… физико-химический метод анализа, позволяющий
- 3. ЭЛЕКТРОДЫ ОПРЕДЕЛЕНИЯ − …… электроды, потенциалы которых
- 4. Электрод I рода.Pt, H2 | H+Pt, H2
- 5. Фриц Габер (1868-1934)СТЕКЛЯННЫЙ ЭЛЕКТРОД
- 6. СТЕКЛЯННЫЙ ЭЛЕКТРОДAg | AgCl, Cl‒ | glass
- 7. ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН1. Водородно ‒
- 8. 2. Водородно ‒ хлорсеребряная цепь:Pt, H2 |
- 9. 3. Водородно ‒ каломельная цепь:Pt, H2 |
- 10. 4. Цепь из стеклянного и хлорсеребряного электрода:Ag
- 11. ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- 12. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1ПОТЕНЦИОМЕТРИЯ. ИСПОЛЬЗОВАНИЕ В ДИАГНОСТИКЕ ЗАБОЛЕВАНИЙ И ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ
Лекция №17
курса
Слайд 2ПОТЕНЦИОМЕТРИЯ − …
… физико-химический метод анализа, позволяющий определить активности (а)
ионов на основе измерения Е (ЭДС) электрохимической цепи, состоящей из
электрода сравнения и электрода определения, опущенных в исследуемый раствор.Слайд 3ЭЛЕКТРОДЫ ОПРЕДЕЛЕНИЯ − …
… электроды, потенциалы которых зависят от концентрации
анализируемых ионов и практически не зависят от содержания других ионов
в растворе.Электроды определения
Стеклянный
Водородный
Слайд 4
Электрод I рода.
Pt, H2 | H+
Pt, H2 − 2ē →
2H+
Условия:
РН2 = 1атм
[Н+] ≠ 1моль/л
ϕН2 = ϕ° + 0,059 ⋅
lg аН+рН = − lg аН+
ϕН2 = −0,059 ⋅ рН
ВОДОРОДНЫЙ ЭЛЕКТРОД
При положительных значениях рН ‒ ϕН2 всегда отрицателен!
Слайд 6
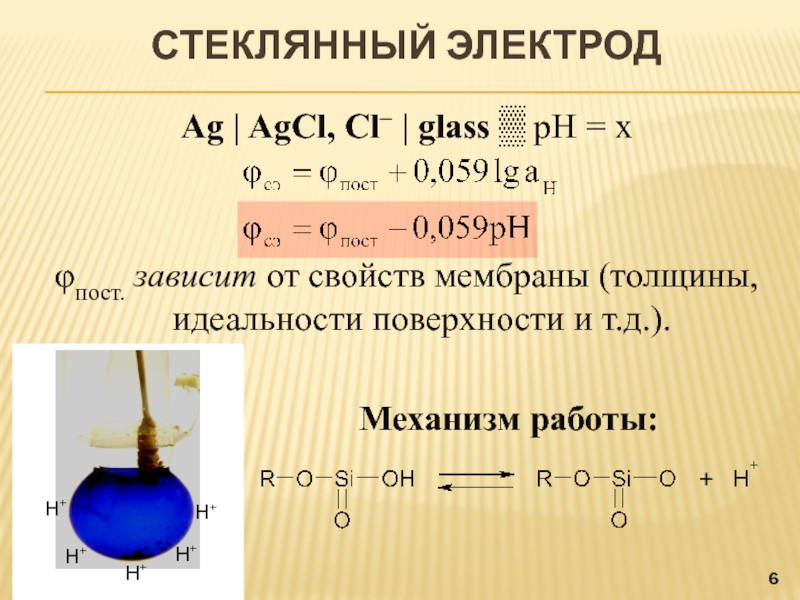
СТЕКЛЯННЫЙ ЭЛЕКТРОД
Ag | AgCl, Cl‒ | glass ▒ pH =
x
φпост. зависит от свойств мембраны (толщины, идеальности поверхности и т.д.).
Механизм
работы:Н+
Н+
Н+
Н+
Н+
Слайд 7
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН
1. Водородно ‒ водородная (газовая) цепь:
Pt,
H2 | H+ || H+ | H2, Pt
Анод: ½H2 ‒
ē → H+ H+ + ē → ½H2 :КатодЭлектрод Электрод
определения сравнения
E = φ0H2 ‒ φH2 = ‒ φH2 = 0,059pH
Слайд 8
2. Водородно ‒ хлорсеребряная цепь:
Pt, H2 | H+ || Cl
‒, AgCl | Ag
Электрод
Электродопределения сравнения
E = φAgCl ‒ φH2 = φAgCl + 0,059pH
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН
Слайд 9
3. Водородно ‒ каломельная цепь:
Pt, H2 | H+ || Сl‒,
Hg2Cl2 | Hg
Электрод
Электродопределения сравнения
E = φHg2Cl2 ‒ φH2 = φHg2Cl2 + 0,059pH
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН
Слайд 10
4. Цепь из стеклянного и хлорсеребряного электрода:
Ag | AgCl, Cl‒
¦ pH=x | Cl‒, AgCl | Ag
Электрод определения
Электрод сравненияE = φAgCl ‒ φсэ = φAgCl ‒ φпост + 0,059pH
ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН+



![Потенциометрия. Использование в диагностике заболеваний и охране окружающей среды Электрод I рода.Pt, H2 | H+Pt, H2 − 2ē → 2H+Условия:РН2 Электрод I рода.Pt, H2 | H+Pt, H2 − 2ē → 2H+Условия:РН2 = 1атм[Н+] ≠ 1моль/лϕН2 = ϕ°](/img/thumbs/727fcece28b5a57e1f7a48ce380c81cc-800x.jpg)