Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
ТЕМА УРОКА:
Содержание
- 1. ТЕМА УРОКА:
- 2. Слайд 2
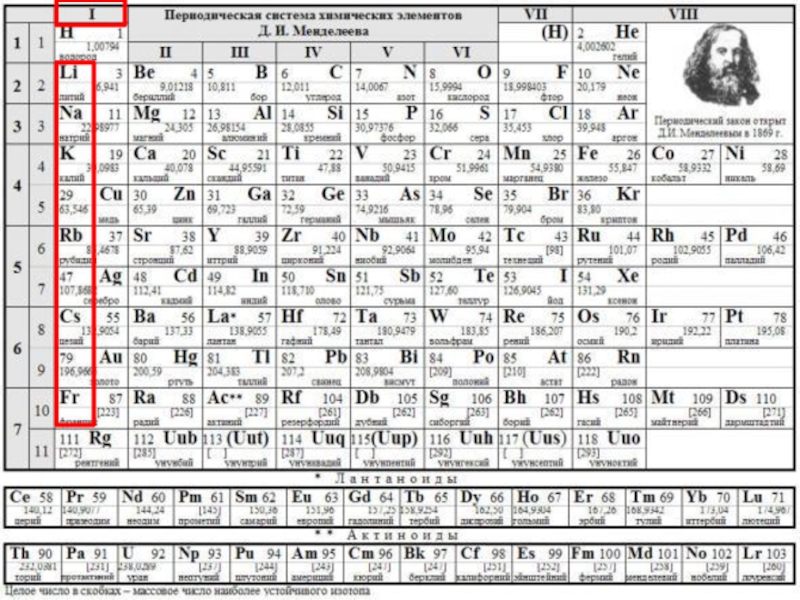
- 3. Строение атома+31+11+19+37+55+8711111- 1 е- 1 е- 1 е- 1 е- 1 е- 1 е Li+Na+K+Rb+Cs+Fr+
- 4. Строение атома+31+11+19+37+55+87111111.Увеличивается заряд ядра3.Увеличивается радиус атома4.Увеличиваются металлические и восстановительные свойства2.Растет число энергетических уровней
- 5. Запомни!Степень окисления металлов I группы главной подгруппы
- 6. Простые веществаСеребристо-белые, с характерным металлическим блеском, но
- 7. Химические свойства Металлы I группы главной подгруппы
- 8. Взаимодействуют с неметаллами Li + S2 e-ВосстановительОкислительСУЛЬФИД ЛИТИЯ Na + P3 e -ВосстановительОкислительФОСФИД НАТРИЯ+100+1Li2S2Na3 P3
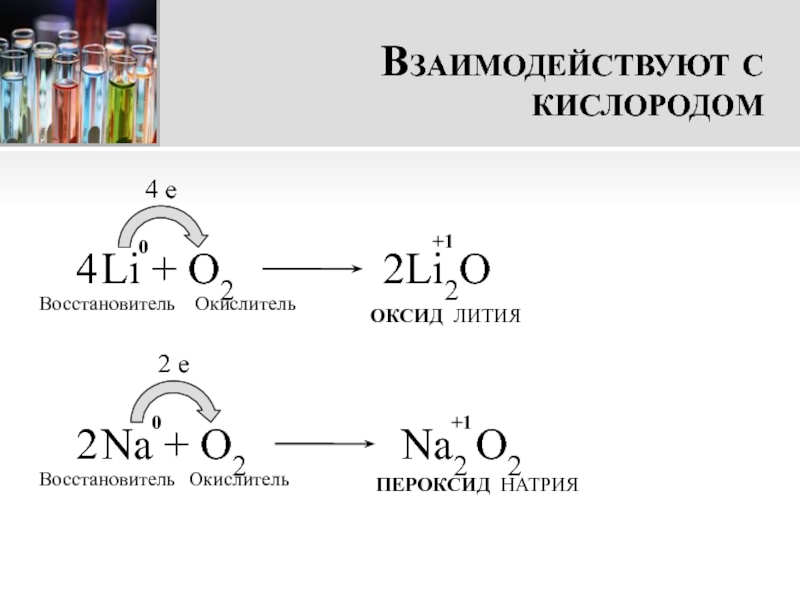
- 9. Взаимодействуют с кислородом Li + О24 eВосстановительОкислительОКСИД ЛИТИЯ Na + O22 eВосстановительОкислительПЕРОКСИД НАТРИЯ+100+12Li2O4Na2 O22
- 10. Внимание!При взаимодействии с кислородом только литий образует
- 11. A знаете ли вы?При взаимодействии пероксида натрия
- 12. Взаимодействуют с водойМеталлы I группы главной подгруппы
- 13. Взаимодействуют с водой 2Li + 2H2О
- 14. Хранение щелочных металловТак как щелочные металлы легко
- 15. Нахождение в природеЩелочные металлы в природе встречаются
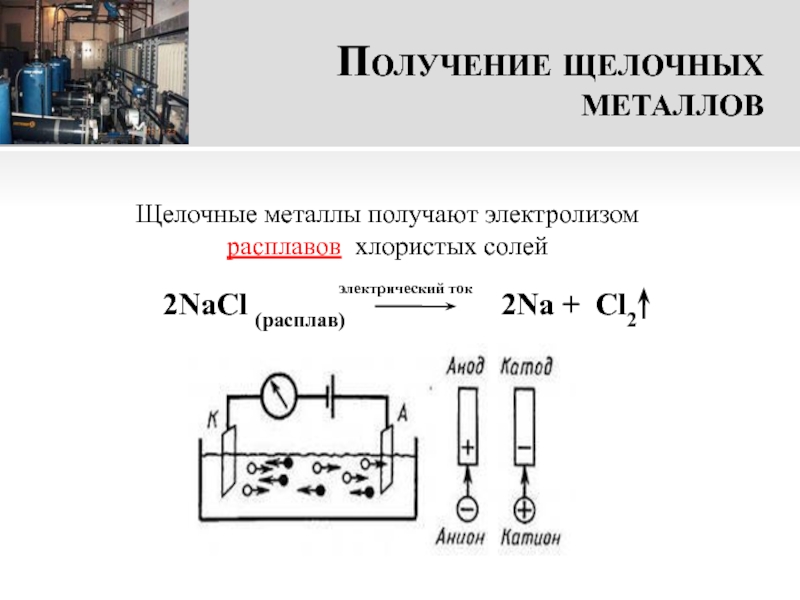
- 16. Получение щелочных металлов2NaCl (расплав)
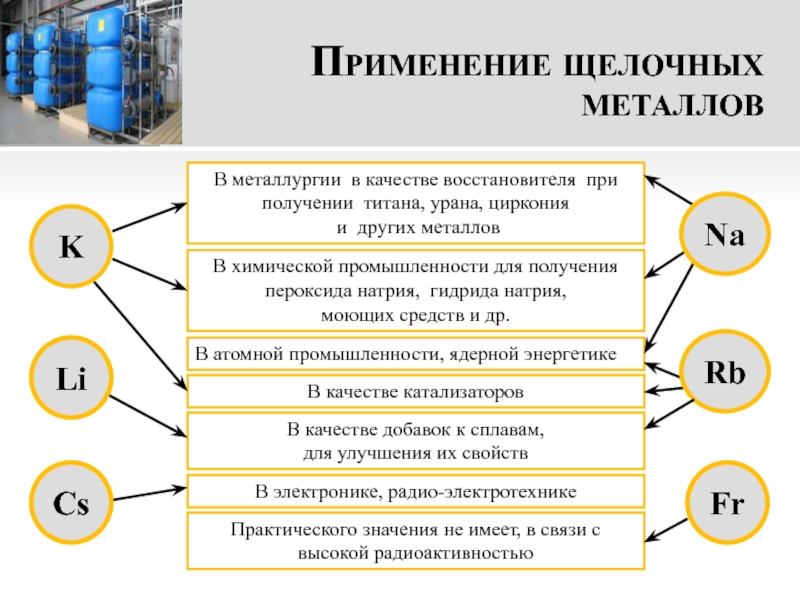
- 17. Применение щелочных металловВ металлургии в качестве восстановителя
- 18. Из истории
- 19. Домашнее заданиеПараграф 11 (до соединений щелочных металлов) Упр. 1, 2
- 20. Выбери правильный ответ1. Щелочной металл a) Mg
- 21. Найди соответствие1. Li 2. Na 3. K
- 22. Выберите свойства характерные для щелочных металловА) не
- 23. Скачать презентанцию
Слайды и текст этой презентации
Слайд 4Строение атома
+3
1
+11
+19
+37
+55
+87
1
1
1
1
1
1.Увеличивается заряд ядра
3.Увеличивается радиус атома
4.Увеличиваются металлические и восстановительные свойства
2.Растет
число энергетических уровней
Слайд 5Запомни!
Степень окисления металлов I группы главной подгруппы в соединениях постоянная
и равна +1
NaOH, K2O, Li3PO4,
K2CO3, NaCl, Na2O2
+1
+1
+1
+1
+1
+1
Слайд 6Простые вещества
Серебристо-белые, с характерным металлическим блеском, но быстро тускнеют (окисляются)
на воздухе;
Мягкие, легко режутся ножом;
Хорошо проводят тепло и электрический ток;
Легкие
(Li, Na, K – легче воды);Легкоплавкие
температуры плавления и кипения понижаются
плотность металлов увеличивается
Слайд 7Химические свойства
Металлы I группы главной подгруппы –
наиболее
активные металлы,
обладают высокой восстановительной способностью
В ряду Li - Na
- K - Rb - Cs- Fr химическая активность увеличивается
Образуют соединения с ионной связью и ионной кристаллической решеткой
Слайд 8Взаимодействуют с неметаллами
Li + S
2 e-
Восстановитель
Окислитель
СУЛЬФИД ЛИТИЯ
Na +
P
3 e -
Восстановитель
Окислитель
ФОСФИД НАТРИЯ
+1
0
0
+1
Li2S
2
Na3 P
3
Слайд 9Взаимодействуют с кислородом
Li + О2
4 e
Восстановитель
Окислитель
ОКСИД ЛИТИЯ
Na +
O2
2 e
Восстановитель
Окислитель
ПЕРОКСИД НАТРИЯ
+1
0
0
+1
2Li2O
4
Na2 O2
2
Слайд 10Внимание!
При взаимодействии с кислородом
только литий образует оксид.
Другие металлы
I группы главной подгруппы при взаимодействии с кислородом образуют пероксиды.
ПЕРОКСИД НАТРИЯ
Na O O Na
+1
-1
-1
+1
Слайд 11A знаете ли вы?
При взаимодействии пероксида натрия с углекислым газом
протекает процесс, обратный дыханию - углекислый газ связывается, а кислород
выделяется:2Na2О2 + 2СО2 → 2Na2CО3 + О2
На этой реакции основано применение пероксида натрия для получения кислорода на подводных лодках и для регенерации воздуха в закрытых помещениях.
Слайд 12Взаимодействуют с водой
Металлы I группы главной подгруппы реагируют с водой
бурно, с выделением теплоты. В результате взаимодействия образуется щелочь и
выделяется водородТак как гидроксиды металлов I группы главной подгруппы образуют щелочи, то их групповое название – ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Слайд 13Взаимодействуют с водой
2Li + 2H2О
2LiOH + H2
2 e
Восстановитель
Окислитель
ГИДРОКСИД ЛИТИЯ
Восстановитель
Окислитель
ГИДРОКСИД НАТРИЯ
+1
0
Na +
H2О2 NaOH + H2
2
2
0
+1
2 e
Слайд 14Хранение щелочных металлов
Так как щелочные металлы легко окисляются и обладают
высокой химической активностью, их хранят под слоем керосина
Беречь от воды
Слайд 15Нахождение в природе
Щелочные металлы в природе встречаются только в виде
соединений. Почему?
Na Cl
Галит, поваренная соль
Na Cl • K Cl
Сильвинит
K Cl•
Mg Cl2• 6H2OКарналлит
Na2SO4 • 10H2O
Мирабилит, глауберова соль
В океанических
водах
В минералах и горных породах
В живых организмах
Рубидий и цезий встречаются в виде примесей к другим щелочным металлам
Франций содержится в урановых рудах
Слайд 16Получение щелочных металлов
2NaCl (расплав)
2Na + Cl2
Щелочные металлы получают электролизом расплавов хлористых солей
электрический ток
Слайд 17Применение щелочных металлов
В металлургии в качестве восстановителя при получении титана,
урана, циркония
и других металлов
В химической промышленности для получения пероксида
натрия, гидрида натрия, моющих средств и др.
В качестве добавок к сплавам,
для улучшения их свойств
В атомной промышленности, ядерной энергетике
Практического значения не имеет, в связи с высокой радиоактивностью
В качестве катализаторов
В электронике, радио-электротехнике
Na
Rb
Fr
K
Li
Cs
Слайд 20Выбери правильный ответ
1. Щелочной металл
a) Mg
б) Ba
в)
Al
г) Rb
2. Наиболее ярко выражены металлические свойства
a)
Cs г) Li
в) Fr
б) K
3. При взаимодействии с кислородом образует пероксид
a) Ca
б) Na
в) Li
г) Mg
4. Степень окисления щелочных металлов
б) +2
a) +1
в) +3
г) +4
Слайд 21Найди соответствие
1. Li
2. Na
3. K
4. Rb
5.
Cs
А) В атоме 6 энергетических уровней
Б) Заряд ядра
+ 37 В) Самый легкий металл
Г) Общее число электронов в атоме 19
Д) Входит в состав поваренной соли
Слайд 22Выберите свойства характерные для щелочных металлов
А) не взаимодейсвуют с кислородом
Б) в соединениях проявляют переменную степень окисления
В) быстро окисляются
Г) имеют металлическую кристаллическую решетку
Д) при взаимодействии с водой образуют щелочи
Е) хорошие окислители































![Дифференциация звуков
[ с ] - [ ш ]](/img/tmb/6/595029/758adbb20824e4f3c74a5013e14ba3c5-800x.jpg)




