Разделы презентаций
- Разное
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
MOLYBDENUM/TUNGSTEN Nitrogenase Xanthine oxidase Aldehyde Oxidoreductase (MOP)
Содержание
- 1. MOLYBDENUM/TUNGSTEN Nitrogenase Xanthine oxidase Aldehyde Oxidoreductase (MOP)
- 2. Молибденсодержащие ферментыMo
- 3. Мочевая кислота7,9-дигидро-1H-пурин-2,6,8(3H)-трион M 270,000, has 2 flavin
- 4. Биохимия фиксации атмосферного азота
- 5. Фиксация азотаN2 + H2 →
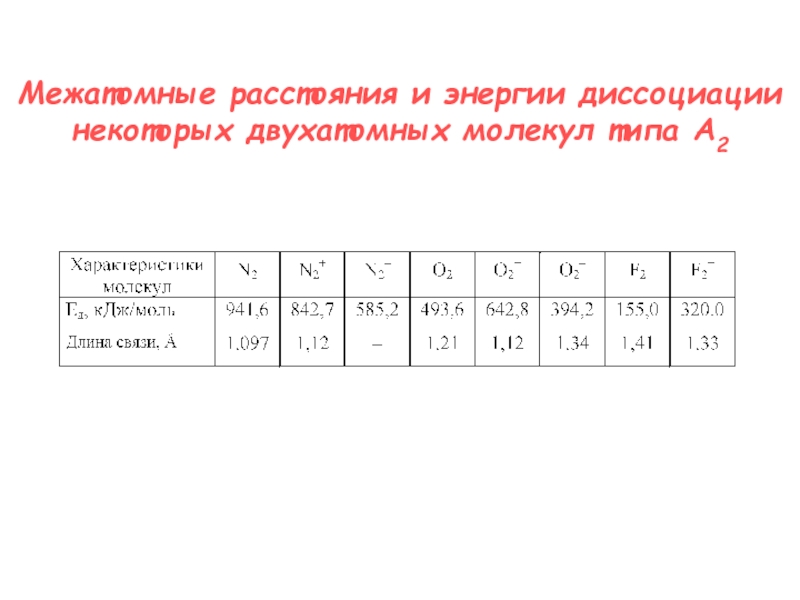
- 6. Межатомные расстояния и энергии диссоциации некоторых двухатомных молекул типа A2
- 7. Слайд 7
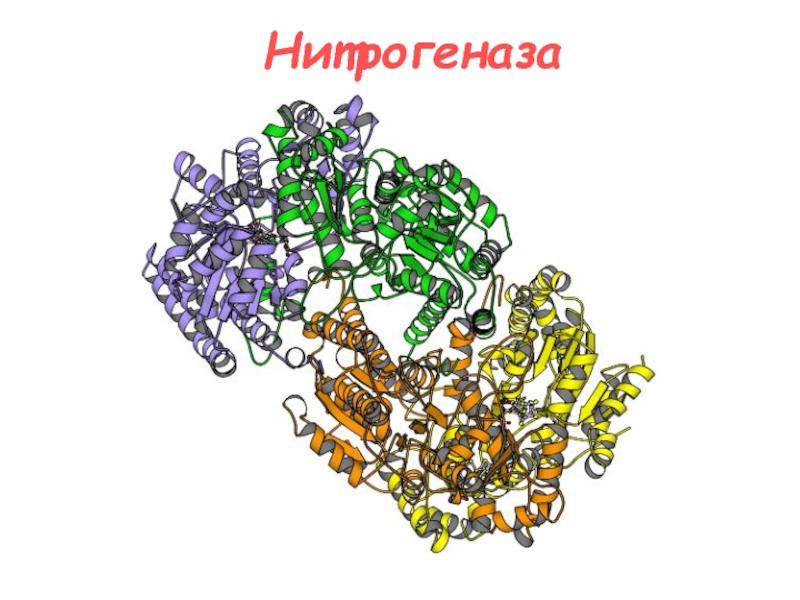
- 8. Нитрогеназа
- 9. Нитрогеназа
- 10. Слайд 10
- 11. Слайд 11
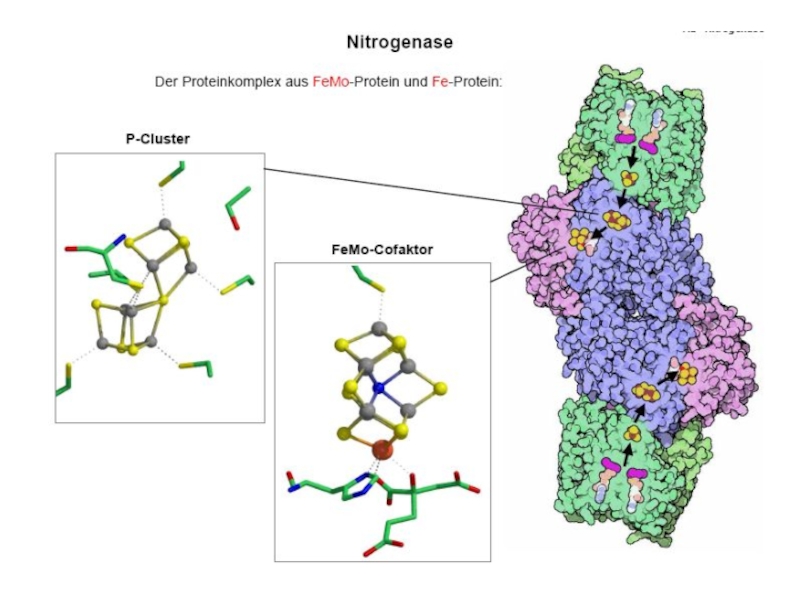
- 12. Строение MoFe-кофактора
- 13. P-кластер в нормальной формеP-кластер в восстановленной форме
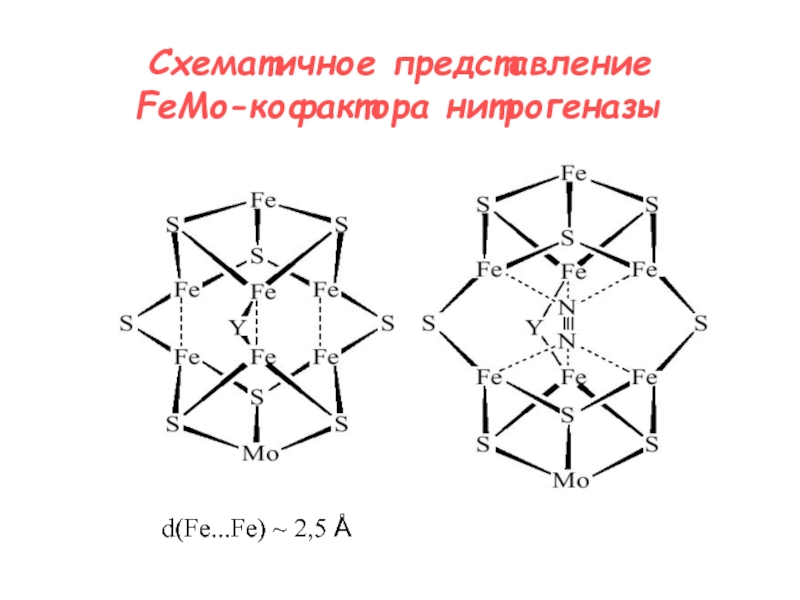
- 14. Схематичное представление FeMo-кофактора нитрогеназыd(Fe...Fe) ~ 2,5 Å
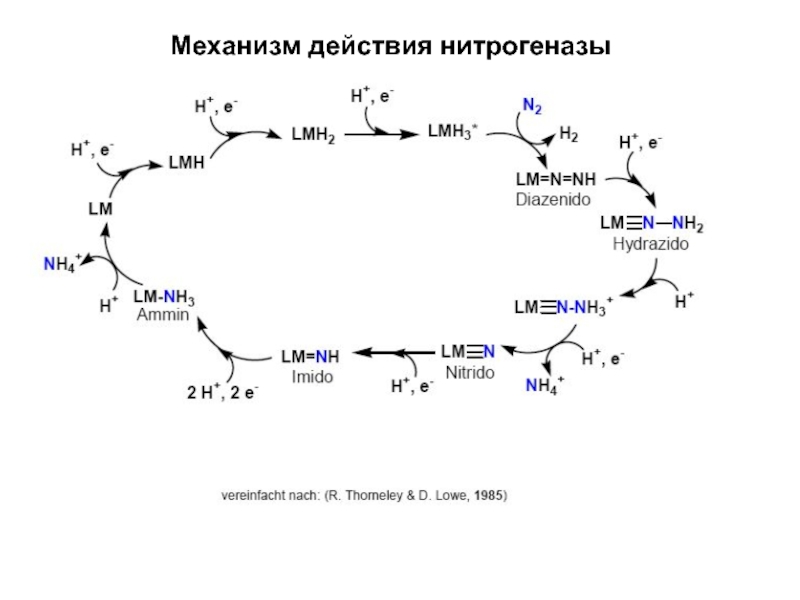
- 15. Механизм действия нитрогеназы
- 16. Процесс восстановления молекулярного азота на молибденсодержащей нитрогеназе:восстановление
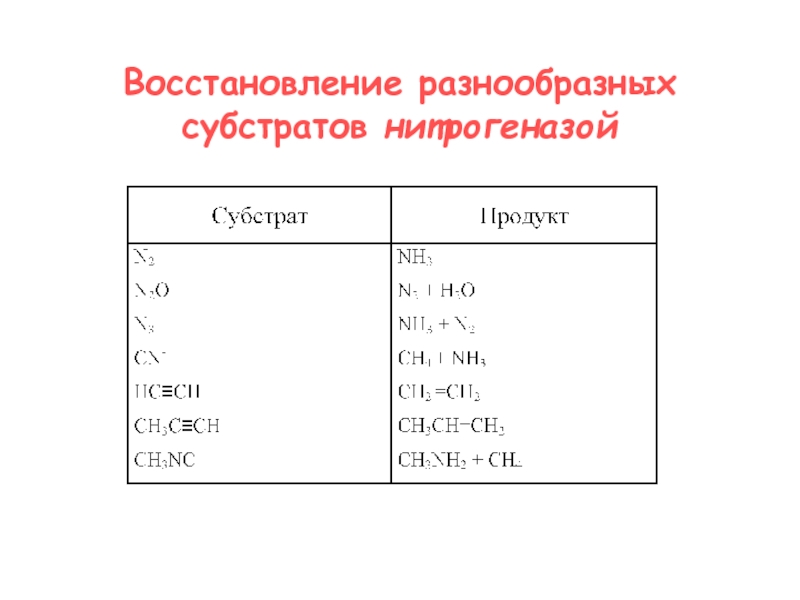
- 17. Восстановление разнообразных субстратов нитрогеназой
- 18. 12 International Conference on Bioinorganic Chemistry (ICBIC-12)
- 19. NiNICKELUrease Nickel-Iron Hydrogenases Methyl-Coenzyme
- 20. NiНикельсодержащие ферментыОксид углерода дегидрогеназаCarbon-monoxide dehydrogenase Кофактор F420 гидрогеназаCoenzyme F420 hydrogenaseЦитохром с3 гидрогеназаCytochrome-c3 hydrogenaseФерредоксин гидрогеназаFerredoxin hydrogenaseУреазаUrease Ni
- 21. Оксид углерода дегидрогеназаCarbon-monoxide dehydrogenaseСодержит [Ni3Fe-4S] и [4Fe-4S]Ингибиторы:
- 22. Уреаза(NH2)2CO + H2O → CO2 + 2NH3Ni···Ni
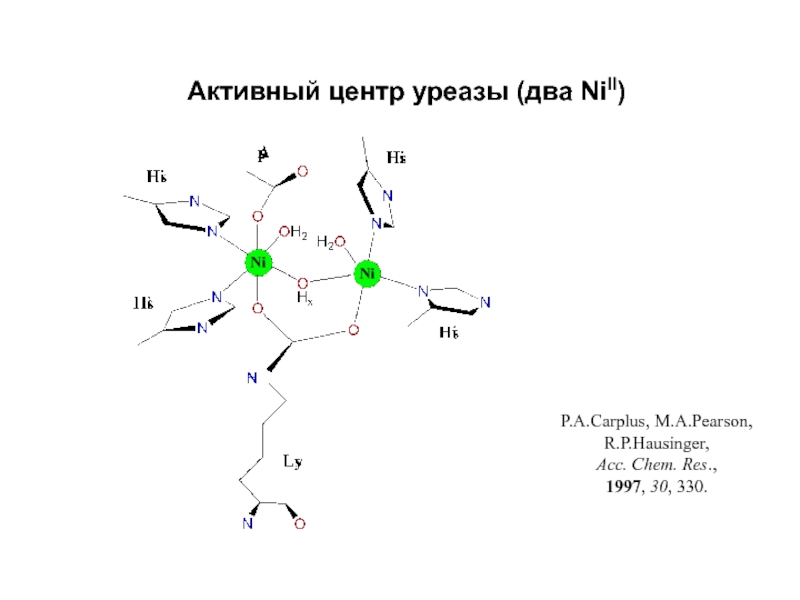
- 23. Активный центр уреазы (два NiII)P.A.Carplus, M.A.Pearson, R.P.Hausinger, Acc. Chem. Res., 1997, 30, 330.
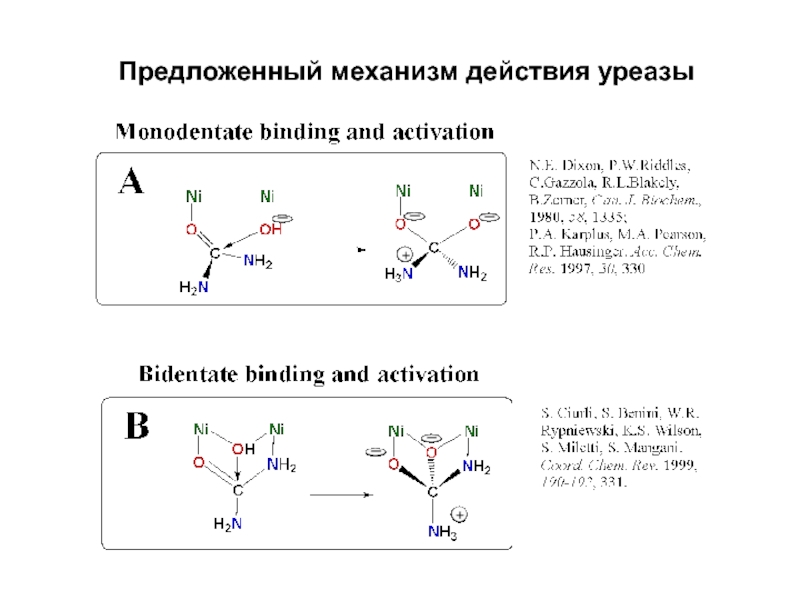
- 24. Предложенный механизм действия уреазы
- 25. Механизм ферментативного действия уреазыТерминальный OH-Переходное состояниеАктивный центркарбаматуреазаk
- 26. Синтетические модели активного центра уреазы[Ni2(OAc)3(tmen)2(urea)]+H.E. Wages, K.L.Taft,
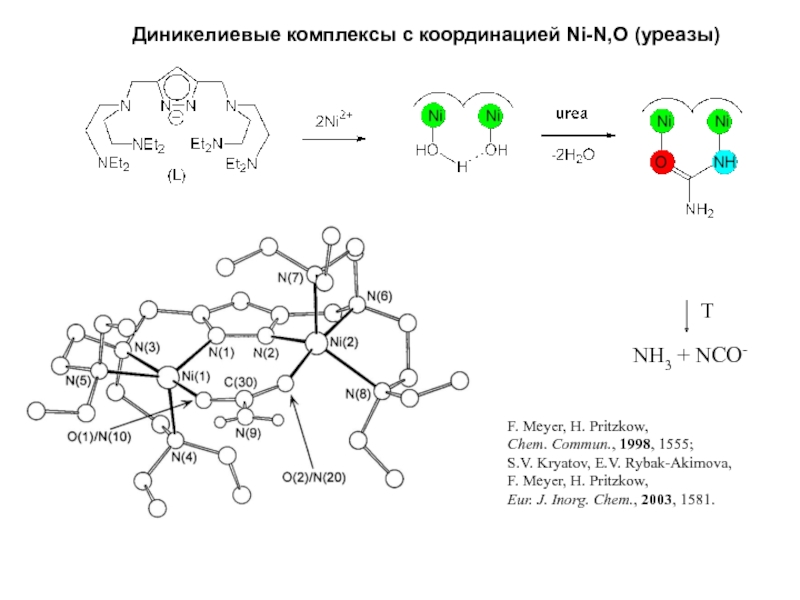
- 27. F. Meyer, H. Pritzkow, Chem. Commun., 1998,
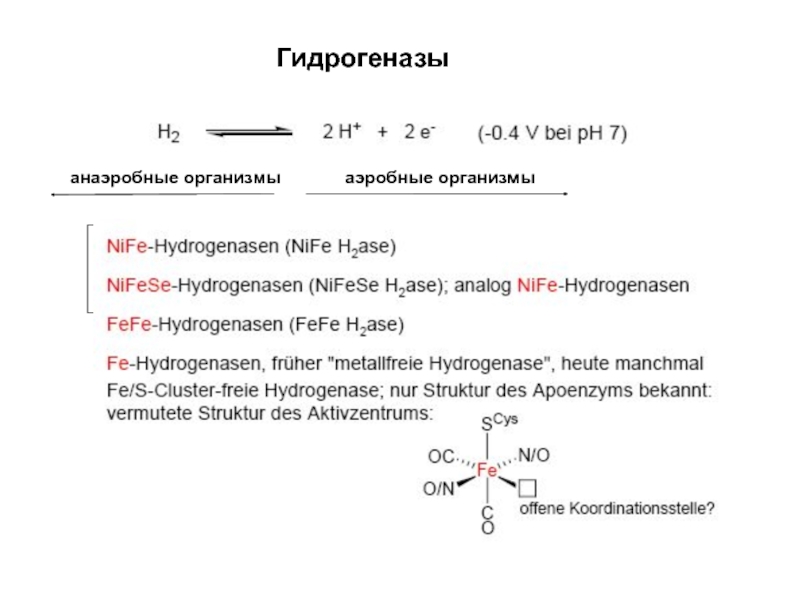
- 28. Гидрогеназыанаэробные организмыаэробные организмы
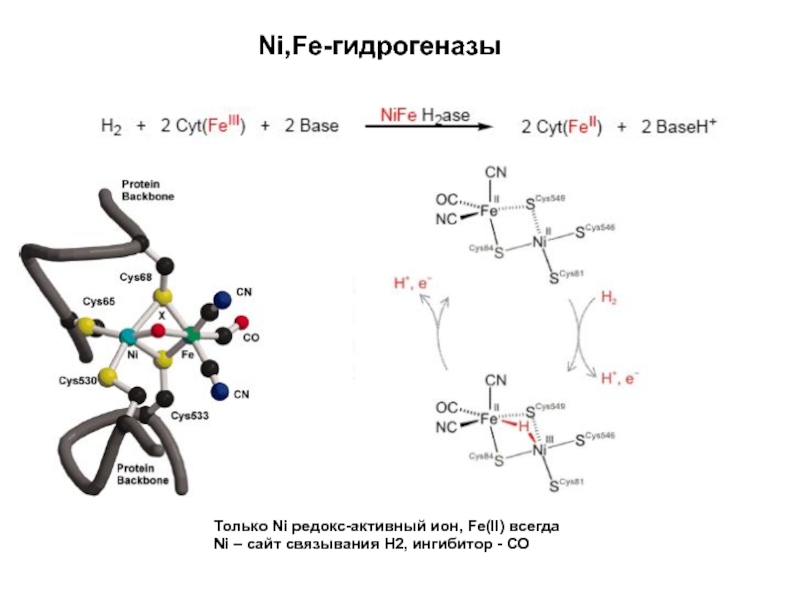
- 29. Ni,Fe-гидрогеназыТолько Ni редокс-активный ион, Fe(II) всегдаNi – сайт связывания Н2, ингибитор - СО
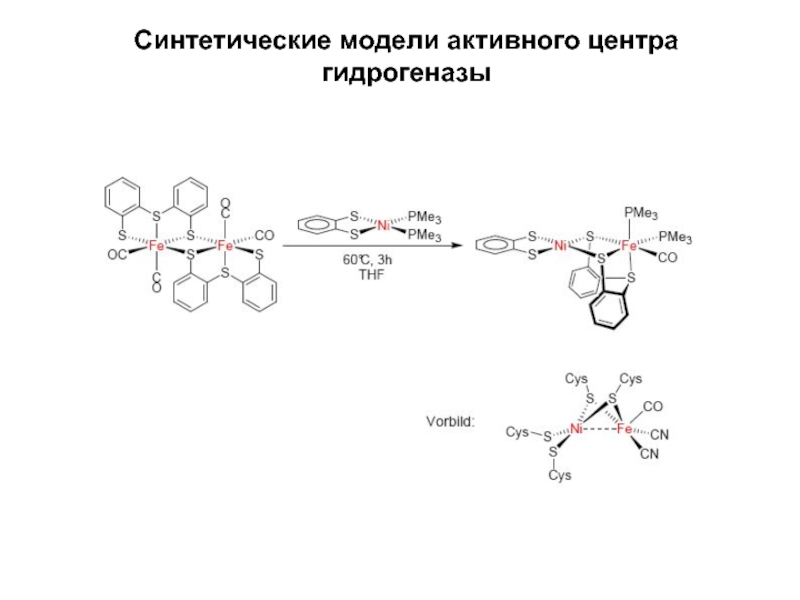
- 30. Синтетические модели активного центра гидрогеназы
- 31. MANGANESEUrease Manganese Superoxide Dismutase
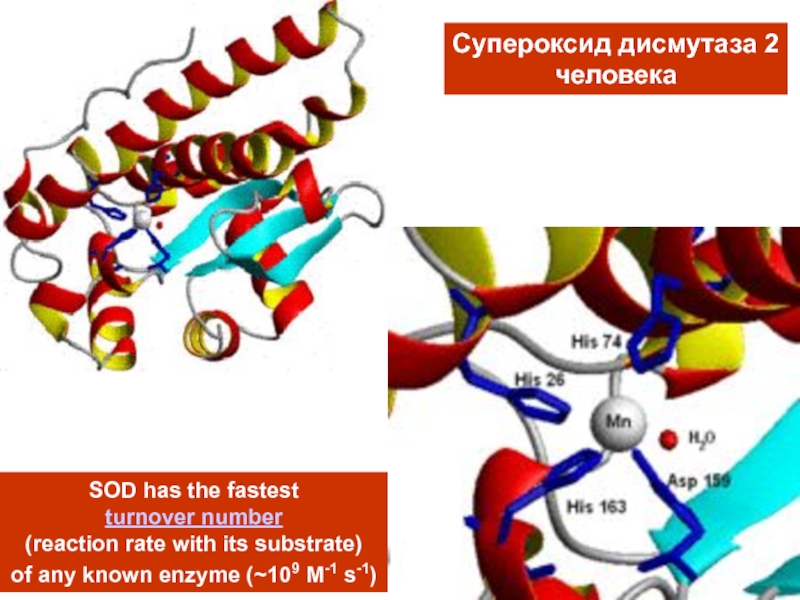
- 32. MnМарганецсодержащие ферментыСупероксид дисмутазаSuperoxide dismutase (SOD)АргиназаArginase
- 33. MnМарганецсодержащие ферментыСупероксид дисмутазаSuperoxide dismutase (SOD)M(n+1)+ − SOD + O2−•
- 34. Супероксид дисмутаза 2человекаSOD has the fastest turnover
- 35. X-Ray Structure of Rat Liver ArginasePDB code:1RLAKanyo,
- 36. аргинин + H2O → орнитин + мочевина АргиназаАргининОрнитин
- 37. Механизм гидролиза аргининаБиядерный центр (2 Mn) необходим
- 38. Аргиназа2Mn2+ coordinate with H2O, orientating and stabilizing
- 39. Page 992ArginaseThe urea cycle
- 40. Семейство галопероксидаз:CPO (хлоро), BPO (бромо), IPO (иодо)Содержат
- 41. Кофактор – аденозилкобаламин (AdoCbl) витамин В12 The
- 42. CoКофактор ферментов класса изомераз(витамин В12) – аденозилкобаламин AdoCbl 5’-дезоксиаденозилкобаламинМеталлоорганическое соединение со связью Со-С
- 43. Слайд 43
- 44. Catalyzes urea hydrolysisVery efficient enzyme (1014 rate
- 45. Urea: An Important BiomoleculeEnd-product of N-catabolism in
- 46. Urease: A Dinuclear EnzymeEnzymatic reaction: (NH2)2CO +
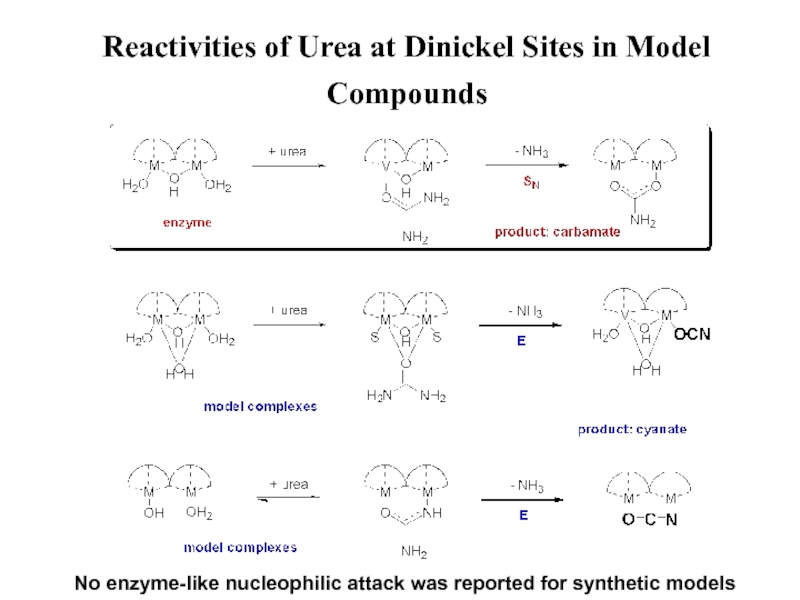
- 47. Urea Transformation at a Dinickel Site[Ni2(bdptz)(OH)(urea)2(MeCN)]+A.M. Barrios, S.J. Lippard, J. Am. Chem. Soc., 2000, 122, 9172.NH4NCOT
- 48. Reactivities of Urea at Dinickel Sites in
- 49. Скачать презентанцию
Слайды и текст этой презентации
Слайд 1MOLYBDENUM/TUNGSTEN
Nitrogenase
Xanthine oxidase
Aldehyde Oxidoreductase (MOP)
Dimethylsulfoxide Reductase
Trimethylamine N-Oxide Reductase
Dissimilatory Nitrate Reductase
Formaldehyde Ferredoxin
Oxidoreductase
Aldehyde Ferredoxin Oxidoreductase
Formate Dehydrogenase H
Sulfite Oxidase
CO Dehydrogenase
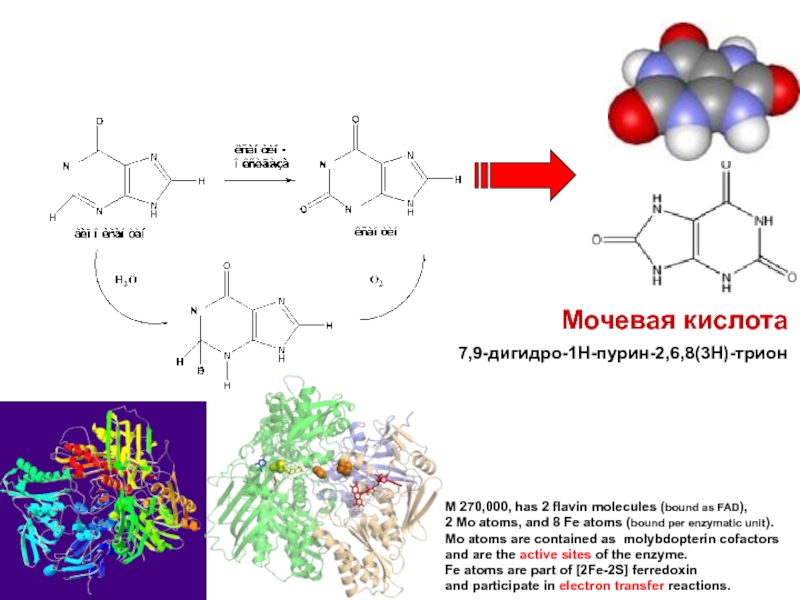
Слайд 3Мочевая кислота
7,9-дигидро-1H-пурин-2,6,8(3H)-трион
M 270,000, has 2 flavin molecules (bound as
FAD),
2 Mo atoms, and 8 Fe atoms (bound per
enzymatic unit). Mo atoms are contained as molybdopterin cofactors
and are the active sites of the enzyme.
Fe atoms are part of [2Fe-2S] ferredoxin
and participate in electron transfer reactions.
Слайд 5Фиксация азота
N2 + H2 → NH3
G0’ = - 19 ккал/моль
N ≡ N
225 ккал/мольУсловия в промышленности: 400 атм, 450 ºC
Бактерии, фиксирующие азот,
содержат нитрогеназу
Условия:
1 атм, комнатная температура
Streptomyces thermoautotrophicus
опт. темп. 65 ºC
Слайд 16Процесс восстановления молекулярного азота на молибденсодержащей нитрогеназе:
восстановление Fe-белка донорами электронов
перенос
электронов с восстановленного Fe-белка на MoFe-белок
перенос электронов на молекулу N2
N2
+ 8e + 8H+ + 16MgАТФ 2NH3 + H2 + 16MgАДФ+ 16PO43-Слайд 19Ni
NICKEL
Urease
Nickel-Iron Hydrogenases
Methyl-Coenzyme M Reductase
Peptide Deformylase
Diphtheria Toxin Repressor:
Metal Ion Mediated
Control
Of Transcription
Handbook of Metalloproteins
Слайд 20Ni
Никельсодержащие ферменты
Оксид углерода дегидрогеназа
Carbon-monoxide dehydrogenase
Кофактор F420 гидрогеназа
Coenzyme F420 hydrogenase
Цитохром
с3 гидрогеназа
Cytochrome-c3 hydrogenase
Ферредоксин гидрогеназа
Ferredoxin hydrogenase
Уреаза
Urease
Ni
Слайд 21Оксид углерода дегидрогеназа
Carbon-monoxide dehydrogenase
Содержит [Ni3Fe-4S] и [4Fe-4S]
Ингибиторы: тяжелые металлы
CO
+ H2O + A → CO2 + AH2
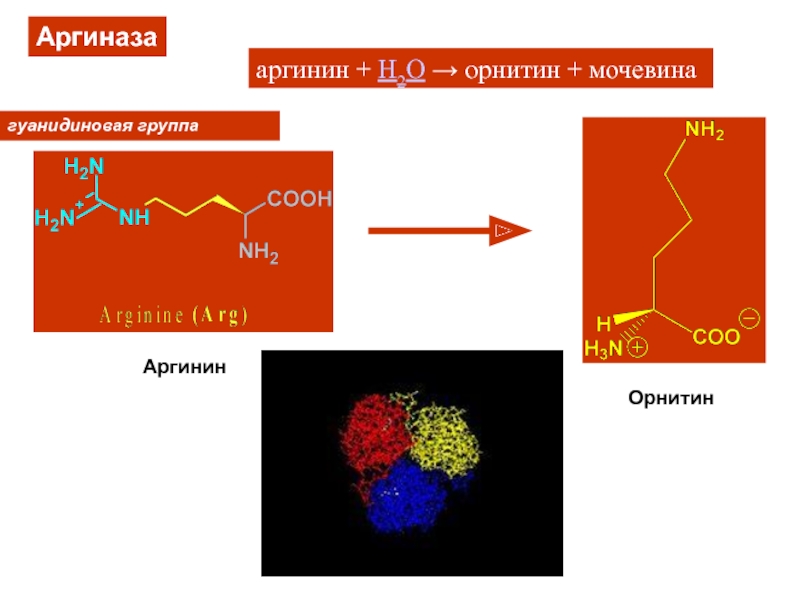
Слайд 22Уреаза
(NH2)2CO + H2O → CO2 + 2NH3
Ni···Ni ~ 3,5 Å
Very
efficient enzyme (1014 rate enhancement)
Мочевина – конечный продукт N-катаболизма у
млекопитающихСлайд 23Активный центр уреазы (два NiII)
P.A.Carplus, M.A.Pearson, R.P.Hausinger,
Acc. Chem. Res.,
1997, 30, 330.
Слайд 25Механизм ферментативного действия уреазы
Терминальный OH-
Переходное состояние
Активный центр
карбамат
уреаза
k × 1014
Некатализируемая реакция:
P.A.
Karplus, M.A. Paerson, R.P. Hausinger, Acc. Chem. Res., 1997, 30,
330.3
Слайд 26Синтетические модели активного центра уреазы
[Ni2(OAc)3(tmen)2(urea)]+
H.E. Wages, K.L.Taft, S.J. Lippard, Inorg.
Chem., 1993, 32, 4985.
[Ni2(L)(OAc)(MeOH)2(urea)]0
S. Mukherjee, T. Weyhermuller, E.Bothe, K. Wieghardt,
P. Chaudhuri, Eur. J. Inorg. Chem., 2003, 863.Комплексы с координацией Ni-O(C=O уреазы)
Слайд 27F. Meyer, H. Pritzkow,
Chem. Commun., 1998, 1555;
S.V. Kryatov,
E.V. Rybak-Akimova,
F. Meyer, H. Pritzkow,
Eur. J. Inorg. Chem.,
2003, 1581.T
NH3 + NCO-
Диникелиевые комплексы с координацией Ni-N,O (уреазы)
Слайд 29Ni,Fe-гидрогеназы
Только Ni редокс-активный ион, Fe(II) всегда
Ni – сайт связывания Н2,
ингибитор - СО
Слайд 31MANGANESE
Urease
Manganese Superoxide Dismutase
Arginase
Concanavalin A
Aminopeptidase P
Handbook of Metalloproteins
Mn
Слайд 33Mn
Марганецсодержащие ферменты
Супероксид дисмутаза
Superoxide dismutase (SOD)
M(n+1)+ − SOD + O2−•
→ Mn+ − SOD + O2
Mn+ − SOD + O2−• + 2H+ → M(n+1)+ − SOD + H2O2
M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2)
Слайд 34Супероксид дисмутаза 2
человека
SOD has the fastest
turnover number
(reaction rate
with its substrate)
of any known enzyme (~109 M-1 s-1)
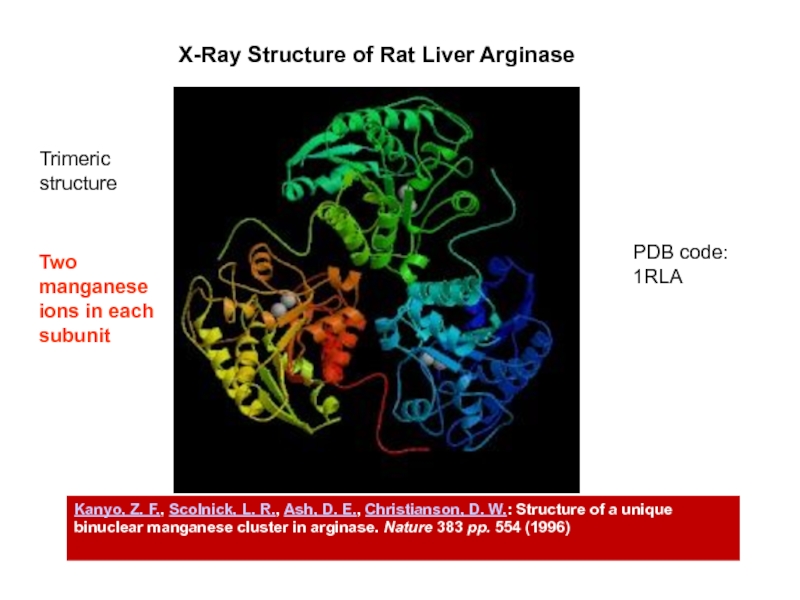
Слайд 35X-Ray Structure of Rat Liver Arginase
PDB code:
1RLA
Kanyo, Z. F., Scolnick,
L. R., Ash, D. E., Christianson, D. W.: Structure of
a unique binuclear manganese cluster in arginase. Nature 383 pp. 554 (1996)Trimeric structure
Two manganese
ions in each subunit
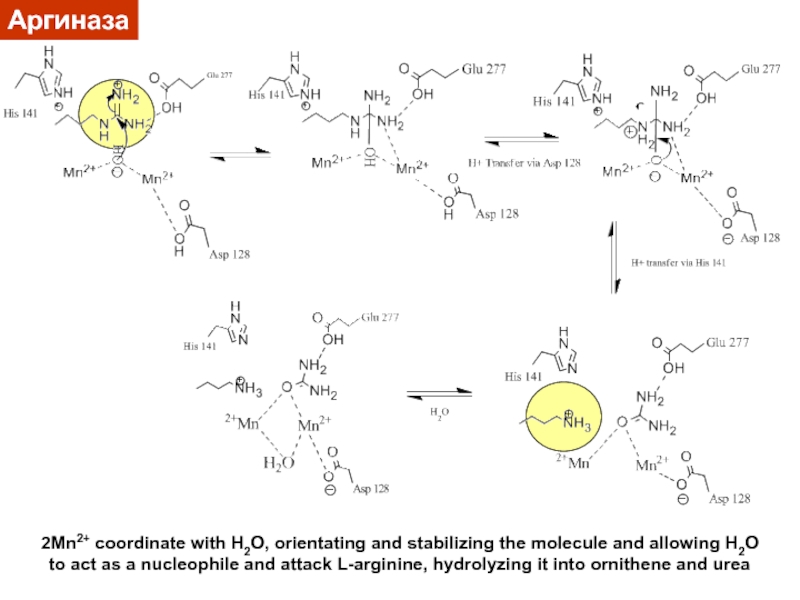
Слайд 37Механизм гидролиза аргинина
Биядерный центр (2 Mn) необходим
для повышения кислотности
координированной молекулы Н2О.
Мостиковый анион HO- стабилен при pH 7.5 и
является нуклеофиломPositively charged guanidinium does not coordinate to the metal ion
(instead, amino acid residues act as substrate binding sites).
(Ash et al. Biochemistry 1994, 10652)
Слайд 38Аргиназа
2Mn2+ coordinate with H2O, orientating and stabilizing the molecule and
allowing H2O
to act as a nucleophile and attack L-arginine,
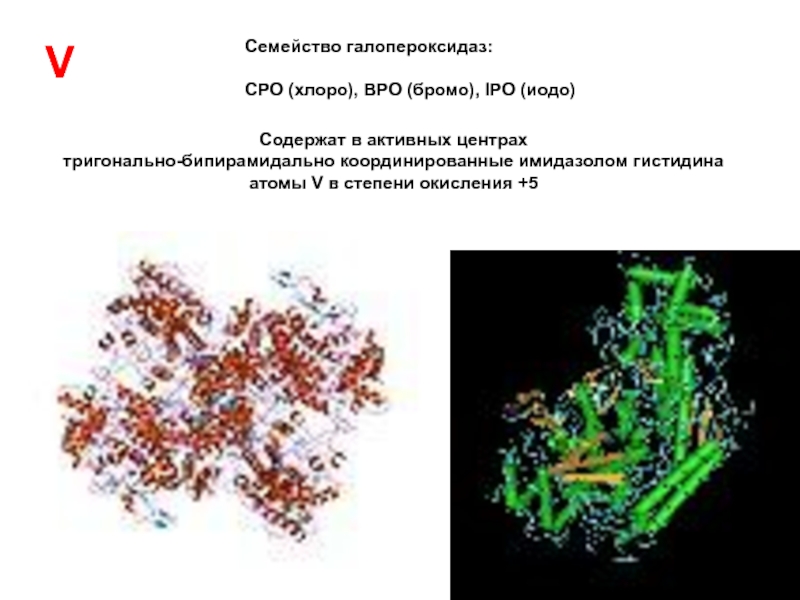
hydrolyzing it into ornithene and urea Слайд 40Семейство галопероксидаз:
CPO (хлоро), BPO (бромо), IPO (иодо)
Содержат в активных центрах
тригонально-бипирамидально координированные имидазолом гистидина атомы V в степени окисления +5
V
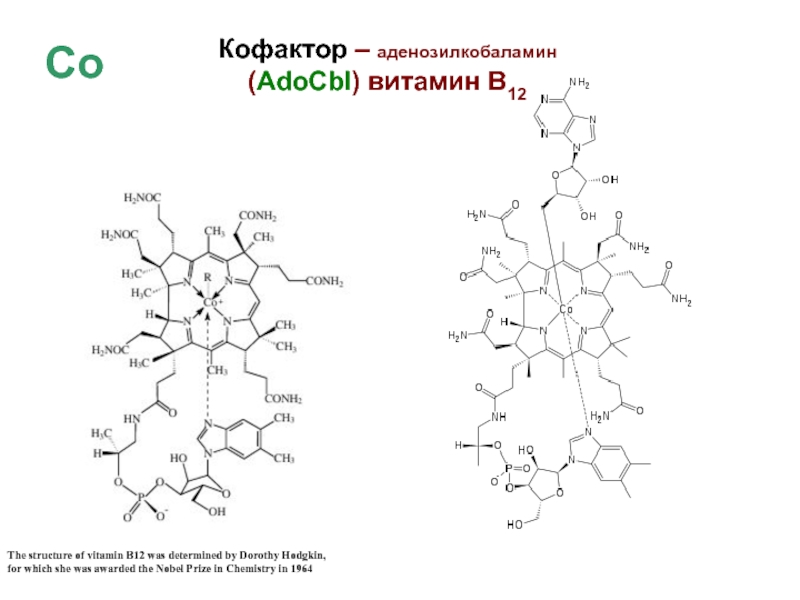
Слайд 41Кофактор – аденозилкобаламин
(AdoCbl) витамин В12
The structure of vitamin
B12 was determined by Dorothy Hodgkin,
for which she was
awarded the Nobel Prize in Chemistry in 1964Со
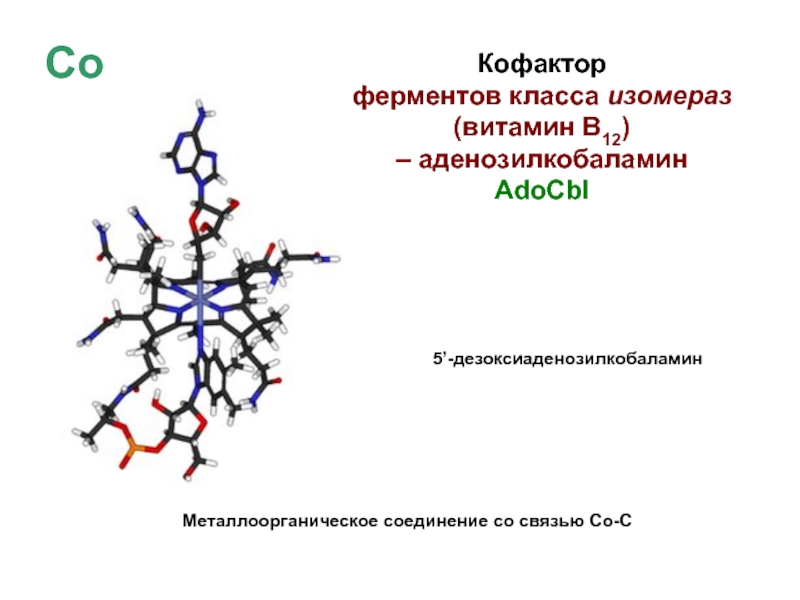
Слайд 42Co
Кофактор
ферментов класса изомераз
(витамин В12)
– аденозилкобаламин
AdoCbl
5’-дезоксиаденозилкобаламин
Металлоорганическое соединение
со связью Со-С
Слайд 44Catalyzes urea hydrolysis
Very efficient enzyme (1014 rate enhancement)
The first enzyme
to be crystallized; retained catalytic activity (Sumner, 1925).
Conclusion: enzymes are
proteinsThe first enzyme shown to contain and require nickel (Zerner, 1975)
UREASE
Слайд 45Urea: An Important Biomolecule
End-product of N-catabolism in mammals
Chemical breakdown required
for anabolism by plants and microorganisms
Chemically inert; stabilized by resonance
d(C-O)
= 1.25, d(C-N) = 1.34 Å: typical for double bondsEres= 30-40 kcal/mol
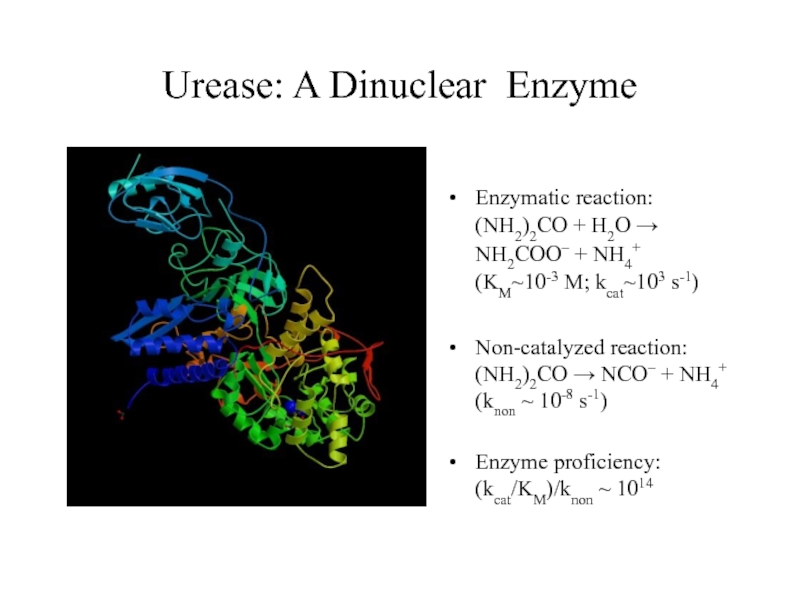
Слайд 46Urease: A Dinuclear Enzyme
Enzymatic reaction: (NH2)2CO + H2O
NH2COO– + NH4+ (KM~10-3 M; kcat~103
s-1)Non-catalyzed reaction: (NH2)2CO NCO– + NH4+ (knon ~ 10-8 s-1)
Enzyme proficiency: (kcat/KM)/knon ~ 1014












![MOLYBDENUM/TUNGSTEN
Nitrogenase Xanthine oxidase
Aldehyde Oxidoreductase (MOP) Оксид углерода дегидрогеназаCarbon-monoxide dehydrogenaseСодержит [Ni3Fe-4S] и [4Fe-4S]Ингибиторы: тяжелые металлы CO + Оксид углерода дегидрогеназаCarbon-monoxide dehydrogenaseСодержит [Ni3Fe-4S] и [4Fe-4S]Ингибиторы: тяжелые металлы CO + H2O + A → CO2 +](/img/thumbs/951eba6dc6ba9770d90381358d4621d9-800x.jpg)


![MOLYBDENUM/TUNGSTEN
Nitrogenase Xanthine oxidase
Aldehyde Oxidoreductase (MOP) Синтетические модели активного центра уреазы[Ni2(OAc)3(tmen)2(urea)]+H.E. Wages, K.L.Taft, S.J. Lippard, Inorg. Chem., Синтетические модели активного центра уреазы[Ni2(OAc)3(tmen)2(urea)]+H.E. Wages, K.L.Taft, S.J. Lippard, Inorg. Chem., 1993, 32, 4985.[Ni2(L)(OAc)(MeOH)2(urea)]0S. Mukherjee, T. Weyhermuller,](/img/thumbs/6c9262f53b6c71bc4ba368c2e943574c-800x.jpg)








![MOLYBDENUM/TUNGSTEN
Nitrogenase Xanthine oxidase
Aldehyde Oxidoreductase (MOP) Urea Transformation at a Dinickel Site[Ni2(bdptz)(OH)(urea)2(MeCN)]+A.M. Barrios, S.J. Lippard, J. Am. Chem. Soc., 2000, 122, 9172.NH4NCOT Urea Transformation at a Dinickel Site[Ni2(bdptz)(OH)(urea)2(MeCN)]+A.M. Barrios, S.J. Lippard, J. Am. Chem. Soc., 2000, 122, 9172.NH4NCOT](/img/thumbs/1b7c1f33a67dfc461097e267442cffcc-800x.jpg)